1 . 某含铬矿石的回收生产中得到BaCrO4的样品,为了测定其中BaCrO4的含量,进行以下实验: =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应
1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为_____ (用字母表示)。
2.若加入的HI溶液过量太多,测定结果会_____。
3.用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx),转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4) 2与Ce2 (SO4)3的混合溶液中,其转化过程如图所示。下列说法错误的是_____。
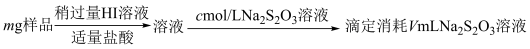
 =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为
2.若加入的HI溶液过量太多,测定结果会_____。
| A.偏高 | B.偏低 | C.无影响 | D.无法确定 |
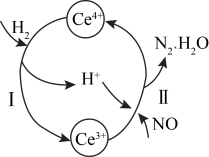
| A.反应I的离子反应方程式为:2Ce4++H2=2Ce3++2H+ |
| B.反应II中氧化剂与还原剂的物质的量之比为1:2 |
| C.反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+) |
| D.反应过程中混合溶液内Ce3+和Ce4+的总数一定保持不变 |
您最近一年使用:0次
2 . 硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与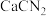 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成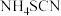 。
。
实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是_______ 。
(2)检查装置气密性后加入药品,打开 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到_______ 时,再打开 。
。
(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是_______ ;装置D中除生成硫脲外,还生成一种碱,写出该过程D中发生反应的化学方程式:_______ 。
实验(二):探究硫脲的性质。
(4)①取少量 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加_______ ,可检验是否有 生成。
生成。
②取少量 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成_______ (填离子符号)。
③取少量 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为_______ 。
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为_______ (用含m、c、V的代数式表示)。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与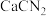 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: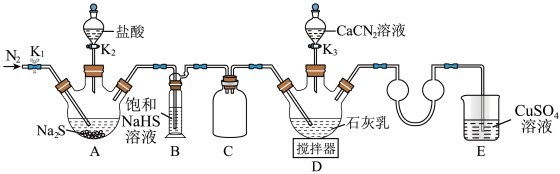
 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成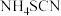 。
。实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是
(2)检查装置气密性后加入药品,打开
 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到 。
。(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是
实验(二):探究硫脲的性质。
(4)①取少量
 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加 生成。
生成。②取少量
 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成③取少量
 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为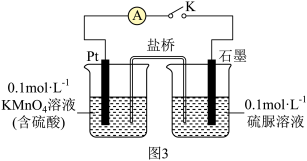
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性
 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
您最近一年使用:0次
名校
解题方法
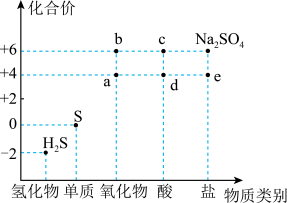
3 . 如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:_____ ,体现了c的_____ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是_____ (填化学式)。
(3)将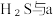 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为_____ 。
(4)配平下列反应:_____ 。
_____
(5)为防止多余的a气体污染环境,应将尾气通入_____ 溶液中;
(6)将足量的 溶液中,下列说法正确的是
溶液中,下列说法正确的是_____ (填字母)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀

(7)将 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为_____ 。 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:_____ 。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是
(3)将
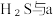 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应:
_____

(5)为防止多余的a气体污染环境,应将尾气通入
(6)将足量的
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(7)将
 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为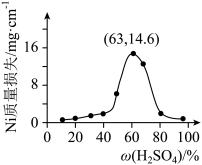
 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近一年使用:0次
4 . 回答下列问题。
(1)向含有NaOH和 的混合溶液中缓缓通入
的混合溶液中缓缓通入 直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
①___________ ;
②___________ ;
③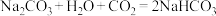 ;
;
④___________ 。
(2)高氯酸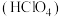 是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。
是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。
①高氯酸氯的化学式为___________ ,物质类别可归为___________ 。
②高氯酸氯在室温下即发生分解,形成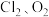 和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:
和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:___________ 。
(3)医药上可用石膏来固定骨折部位。石膏有熟石膏(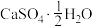 ,一种白色粉末)和生石膏(
,一种白色粉末)和生石膏(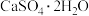 ,一种坚硬的固体)两种,固定骨折的石膏是
,一种坚硬的固体)两种,固定骨折的石膏是___________ (填化学式)。固定时发生反应的化学方程式为___________ 。
(4)CO与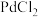 溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为
溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为___________ ,反应中可能看到的现象是___________ 。
(1)向含有NaOH和
 的混合溶液中缓缓通入
的混合溶液中缓缓通入 直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:①
②
③
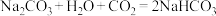 ;
;④
(2)高氯酸
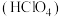 是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。
是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。①高氯酸氯的化学式为
②高氯酸氯在室温下即发生分解,形成
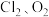 和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:
和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:(3)医药上可用石膏来固定骨折部位。石膏有熟石膏(
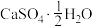 ,一种白色粉末)和生石膏(
,一种白色粉末)和生石膏(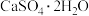 ,一种坚硬的固体)两种,固定骨折的石膏是
,一种坚硬的固体)两种,固定骨折的石膏是(4)CO与
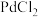 溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为
溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为
您最近一年使用:0次
解题方法
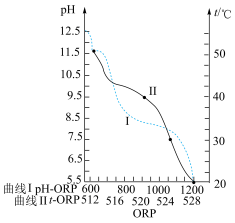
5 . 因“84消毒液”具有强氧化性,常用于环境和物体表面的杀菌、消毒。已知某“84消毒液”瓶体部分的标签如图1所示,图2是利用手持技术测定的“84消毒液”的ORP值(数值越大,氧化能力越强)随 和温度
和温度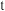 的变化情况。请回答下列问题:
的变化情况。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为______________  (计算结果保留小数点后一位),若取出
(计算结果保留小数点后一位),若取出 该溶液稀释100倍后进行使用,则稀释后溶液中所含
该溶液稀释100倍后进行使用,则稀释后溶液中所含 的物质的量约为
的物质的量约为______________  。
。
(2)图2中“84消毒液”使用时的最佳 和温度依次是
和温度依次是______________ 。使用“84消毒液”时多数需浸泡一段时间消毒且保持较低温度的原因可能是______________ ,结合该分析,请补充“84消毒液”的标签中,[注意]③为______________ 。
(3)“84消毒液”“洁厕灵”(主要成分为盐酸)不能同时使用,请从 元素的化合价角度分析并结合离子方程式解释原因:
元素的化合价角度分析并结合离子方程式解释原因:______________ 。
(4)不能将“84消毒液”与双氧水两种消毒剂混用,否则会产生 ,写出反应的化学方程式:
,写出反应的化学方程式:______________ ,该反应说明氧化性:
______________  (填“>”或“<”)。
(填“>”或“<”)。
 和温度
和温度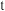 的变化情况。请回答下列问题:
的变化情况。请回答下列问题:| 84消毒液 [有效成分  [规格]  [质量分数]  [密度] 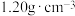 [注意]①外用消毒剂,需稀释后使用,勿口服; ②不能将本品与酸性产品(如洁厕类清洁产品)同时使用; ③______________。 |
图1

图2
(1)该“84消毒液”的物质的量浓度约为
 (计算结果保留小数点后一位),若取出
(计算结果保留小数点后一位),若取出 该溶液稀释100倍后进行使用,则稀释后溶液中所含
该溶液稀释100倍后进行使用,则稀释后溶液中所含 的物质的量约为
的物质的量约为 。
。(2)图2中“84消毒液”使用时的最佳
 和温度依次是
和温度依次是(3)“84消毒液”“洁厕灵”(主要成分为盐酸)不能同时使用,请从
 元素的化合价角度分析并结合离子方程式解释原因:
元素的化合价角度分析并结合离子方程式解释原因:(4)不能将“84消毒液”与双氧水两种消毒剂混用,否则会产生
 ,写出反应的化学方程式:
,写出反应的化学方程式:
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
名校
6 . 离子反应广泛用于化学研究、化工生产、医疗诊断和环境保护等各个领域。
(1)实验室中可利用Na2SO3粉末与质量分数为70%的硫酸反应制取少量SO2,反应的化学方程式_______ 。
(2)已知酸性高锰酸钾溶液可吸收SO2,则该反应的离子方程式为_______ 。
(3)某硫酸厂每天排放1.12×104m3(标准状况)尾气,其中含0.2%(体积分数)的SO2,则其中所含SO2的物质的量为_______ 。现用含NaOH浓度为0.5mol·L-1的废碱液(假设其他成分不参与反应)进行处理,每天至少需要这种废碱液的体积为_______ L。
(4)某同学向BaCl2溶液中通入SO2,未观察到白色沉淀生成,由此可知酸性强H2SO3_______ HCl(填“>”或“<”)。取上述所得溶液进行下列操作,能观察到白色沉淀生成的_______ (填字母)。
A.滴加H2O2溶液 B.滴加稀盐酸 C.滴加NaOH溶液
(1)实验室中可利用Na2SO3粉末与质量分数为70%的硫酸反应制取少量SO2,反应的化学方程式
(2)已知酸性高锰酸钾溶液可吸收SO2,则该反应的离子方程式为
(3)某硫酸厂每天排放1.12×104m3(标准状况)尾气,其中含0.2%(体积分数)的SO2,则其中所含SO2的物质的量为
(4)某同学向BaCl2溶液中通入SO2,未观察到白色沉淀生成,由此可知酸性强H2SO3
A.滴加H2O2溶液 B.滴加稀盐酸 C.滴加NaOH溶液
您最近一年使用:0次
7 . 近来中国隐形战机歼-20换装试飞成功,大大壮我军威。这得益于师昌绪等科学家开发的由新型无机非金属材料制成的新型发动机,热效率高、寿命长。这类材料中研究较多的是化合物G。化合物G的相对分子质量为140,含有硅元素,其质量分数为40%,另含有元素Y。化合物E(含两种元素)与 反应制得G和HCl。
反应制得G和HCl。
(1)G化学式为___________ 。
(2)写出E与 反应的化学方程式:
反应的化学方程式:___________ 。
(3)粉末状G能够与氧气在高温下反应,所得产物中有一种是空气的主要成分,另一种是氧化物,该过程的化学方程式为___________ 。
 反应制得G和HCl。
反应制得G和HCl。(1)G化学式为
(2)写出E与
 反应的化学方程式:
反应的化学方程式:(3)粉末状G能够与氧气在高温下反应,所得产物中有一种是空气的主要成分,另一种是氧化物,该过程的化学方程式为
您最近一年使用:0次
8 . 高铁酸钾(K2FeO4)是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。(已知:Fe3++3H2O⇌Fe(OH)3+3H+)
(1)高铁酸钾可用于杀菌消毒,是因为它具有强___________ 性。
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为________ 。这种分散系区分于其他分散系的最本质区别是_________ 。
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______ +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。
①完成上述离子方程式:___________ 。
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为___________ 。(计算结果保留到0.1%)
湿法制备高铁酸钾的流程如下图。
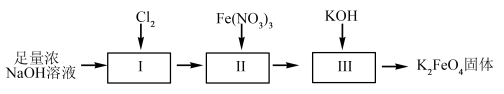
(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。___________ ,反应每生成1molCl-转移的电子数目为___________ 。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

(1)高铁酸钾可用于杀菌消毒,是因为它具有强
(2)高铁酸钾被用于消毒后,产物与水形成一种分散系,其中的分散质能使得水中的悬浮杂质聚沉,方便除去,这是因为
(3)在使用高铁酸钾时,常通过测定其纯度来判断是否变质。K2FeO4在硫酸溶液中发生如下反应:______
 +______H+=_____O2↑+______Fe3++_______。
+______H+=_____O2↑+______Fe3++_______。①完成上述离子方程式:
②现取10.00g样品,加入稀硫酸完全反应后,共收集到0.8064L气体(已换算成标准状况)。则样品中高铁酸钾的质量分数约为
湿法制备高铁酸钾的流程如下图。

(4)过程II为碱性条件下制备高铁酸钠。写出过程II中反应的离子方程式,并标出电子转移方向和数目。
(5)湿法制备时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由下图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。

| A.24℃,75g∙L-1 | B.26℃,75g∙L-1 | C.28℃,75g∙L-1 | D.22℃,80g∙L-1 |
您最近一年使用:0次
9 . 现有下列物质(括号内为对应物质的主要成分):a.熔融NaOH;b.医用酒精;c.蔗糖晶体;d.加碘盐(NaCl和KIO3);e.“84”消毒液(NaClO);f.小苏打(NaHCO3);g.洁厕灵(HCl),回答下列问题:
(1)上述状态下的物质中,属于电解质且能导电的是_______ (填字母,下同);d和f均为厨房中的常用物质,可用于区分两者的物质是________ 。
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:________ 。
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:___________ ;该反应中被氧化的Ⅰ原子与被还原的Ⅰ原子的个数之比为___________ 。
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:_____ ,__NaClO2+__NaHSO4=___ClO2+___NaCl+__Na2SO4+____H2O;若每片泡腾片中NaClO2的质量分数≥17%为合格品,上述所得ClO2溶液的物质的量浓度为0.002mol/L,则所用泡腾片____ (填“属于”或“不属于”)合格品。
(1)上述状态下的物质中,属于电解质且能导电的是
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:
您最近一年使用:0次
名校
解题方法
10 . 工业废水中的氨氮(以 形式存在),可通过微生物法或氧化法处理,转化为
形式存在),可通过微生物法或氧化法处理,转化为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。
(1)微生物法:酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 或
或 或
或 再与
再与 作用生成
作用生成 。
。
① 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
② 与
与 在转化为
在转化为 的反应中消耗
的反应中消耗 与
与 的物质的量之比为
的物质的量之比为_______ 。
(2)次氯酸钠氧化法:向氨氮废水中加入 ,氨氮转化为
,氨氮转化为 而除去。
而除去。
① 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
②一定 下,
下, 的投加量对污水中氨氮去除率的影响如图所示。
的投加量对污水中氨氮去除率的影响如图所示。 :
: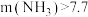 时,总氮的去除率随
时,总氮的去除率随 :
: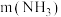 的增大不升反降的原因是
的增大不升反降的原因是_______ 。
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,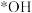 为羟基自由基,其氧化性比
为羟基自由基,其氧化性比 更强。
更强。_______ 。
②其它条件不变调节废水的 ,废水中氨氮去除率随
,废水中氨氮去除率随 的变化如下图所示。随
的变化如下图所示。随 增大氨氮去除率先明显增大,后变化较小,可能的原因是
增大氨氮去除率先明显增大,后变化较小,可能的原因是_______ 。 晶体进行纯度测定:
晶体进行纯度测定:
a.称取 样品,将其配成
样品,将其配成 溶液。
溶液。
b.先向锥形瓶内加入一定浓度的 溶液,加热至
溶液,加热至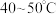 。冷却后再向其中加入
。冷却后再向其中加入
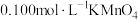 溶液,充分混合。
溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,消耗样品溶液 。
。
(NaNO2与 反应的关系式为:2KMnO4~5NaNO2)
反应的关系式为:2KMnO4~5NaNO2)
通过计算,该样品中 的质量分数是
的质量分数是_______ 。(写出计算过程)
 形式存在),可通过微生物法或氧化法处理,转化为
形式存在),可通过微生物法或氧化法处理,转化为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。(1)微生物法:酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 或
或 或
或 再与
再与 作用生成
作用生成 。
。①
 转化为
转化为 的离子方程式为
的离子方程式为②
 与
与 在转化为
在转化为 的反应中消耗
的反应中消耗 与
与 的物质的量之比为
的物质的量之比为(2)次氯酸钠氧化法:向氨氮废水中加入
 ,氨氮转化为
,氨氮转化为 而除去。
而除去。①
 氧化
氧化 的离子方程式为
的离子方程式为②一定
 下,
下, 的投加量对污水中氨氮去除率的影响如图所示。
的投加量对污水中氨氮去除率的影响如图所示。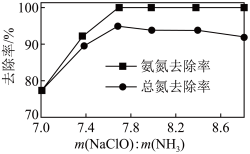
 :
: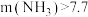 时,总氮的去除率随
时,总氮的去除率随 :
: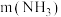 的增大不升反降的原因是
的增大不升反降的原因是(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,
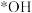 为羟基自由基,其氧化性比
为羟基自由基,其氧化性比 更强。
更强。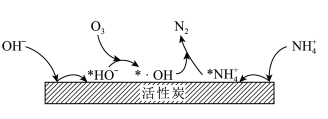
②其它条件不变调节废水的
 ,废水中氨氮去除率随
,废水中氨氮去除率随 的变化如下图所示。随
的变化如下图所示。随 增大氨氮去除率先明显增大,后变化较小,可能的原因是
增大氨氮去除率先明显增大,后变化较小,可能的原因是
 晶体进行纯度测定:
晶体进行纯度测定:a.称取
 样品,将其配成
样品,将其配成 溶液。
溶液。b.先向锥形瓶内加入一定浓度的
 溶液,加热至
溶液,加热至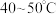 。冷却后再向其中加入
。冷却后再向其中加入
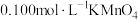 溶液,充分混合。
溶液,充分混合。c.最后用待测的样品溶液与之恰好完全反应,消耗样品溶液
 。
。(NaNO2与
 反应的关系式为:2KMnO4~5NaNO2)
反应的关系式为:2KMnO4~5NaNO2)通过计算,该样品中
 的质量分数是
的质量分数是
您最近一年使用:0次



