名校
解题方法
1 . 制备 (水合肼)和无水
(水合肼)和无水 主要实验流程如图1所示。
主要实验流程如图1所示。

已知:①氯气与烧碱溶液的反应是放热反应;
② 有强还原性,能与
有强还原性,能与 剧烈反应生成
剧烈反应生成 。
。
(1)从流程分析,本流程所用的主要有机原料为____________ (写名称)。
(2)步骤Ⅰ制备 溶液时,若温度为41℃,测得产物中除
溶液时,若温度为41℃,测得产物中除 外还含有
外还含有 ,且两者物质的量之比为
,且两者物质的量之比为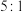 ,该反应的离子方程式为
,该反应的离子方程式为________________________________________________ 。
(3)实验中,为使步骤Ⅰ中反应温度不高于40℃,除减缓 的通入速率外,还可采取的措施是
的通入速率外,还可采取的措施是___________ 。
(4)步骤Ⅱ合成 (沸点约118℃)的装置如图2所示。
(沸点约118℃)的装置如图2所示。 碱性溶液与尿素[
碱性溶液与尿素[ ](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。
](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。

①使用冷凝管的目的是________________________________________________ 。
②滴液漏斗内的试剂是________________ ;将滴液漏斗内的液体放入三颈烧瓶内的操作是_____________ 。
③写出流程中生成水合肼反应的化学方程式__________________________________________ 。
(5)步骤Ⅳ制备无水 (水溶液中
(水溶液中 、
、 、
、 随
随 的分布如图3所示)。
的分布如图3所示)。
①边搅拌边向 溶液中通入
溶液中通入 制备
制备 溶液。实验中确定停止通
溶液。实验中确定停止通 的
的 为
为___________ (取近似整数值,下同)。
②用制得的 溶液再制
溶液再制 溶液的
溶液的 应控制在
应控制在_________________ 。
 (水合肼)和无水
(水合肼)和无水 主要实验流程如图1所示。
主要实验流程如图1所示。
已知:①氯气与烧碱溶液的反应是放热反应;
②
 有强还原性,能与
有强还原性,能与 剧烈反应生成
剧烈反应生成 。
。(1)从流程分析,本流程所用的主要有机原料为
(2)步骤Ⅰ制备
 溶液时,若温度为41℃,测得产物中除
溶液时,若温度为41℃,测得产物中除 外还含有
外还含有 ,且两者物质的量之比为
,且两者物质的量之比为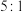 ,该反应的离子方程式为
,该反应的离子方程式为(3)实验中,为使步骤Ⅰ中反应温度不高于40℃,除减缓
 的通入速率外,还可采取的措施是
的通入速率外,还可采取的措施是(4)步骤Ⅱ合成
 (沸点约118℃)的装置如图2所示。
(沸点约118℃)的装置如图2所示。 碱性溶液与尿素[
碱性溶液与尿素[ ](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。
](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。
①使用冷凝管的目的是
②滴液漏斗内的试剂是
③写出流程中生成水合肼反应的化学方程式
(5)步骤Ⅳ制备无水
 (水溶液中
(水溶液中 、
、 、
、 随
随 的分布如图3所示)。
的分布如图3所示)。①边搅拌边向
 溶液中通入
溶液中通入 制备
制备 溶液。实验中确定停止通
溶液。实验中确定停止通 的
的 为
为②用制得的
 溶液再制
溶液再制 溶液的
溶液的 应控制在
应控制在
您最近一年使用:0次
2021-04-30更新
|
573次组卷
|
7卷引用:沪科版高中化学拓展课程第5章《非金属元素》检测题
沪科版高中化学拓展课程第5章《非金属元素》检测题【市级联考】广东省惠州市2019届高三下学期4月模拟考试理科综合化学试题【校级联考】广东省佛山市南海区桂城中学等七校联合体2019届高三下学期冲刺模拟理科综合化学试题解题达人.化学选择题(2021全国卷)精编特训12(已下线)2021年高考化学押题预测卷(福建卷)(03)(含考试版、答题卡、参考答案、全解全析)北京市昌平区新学道临川学校2020届高三上学期期末考试化学试题(已下线)第四章 非金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)
名校
2 . 微型化学实验能有效减少污染,节约药品。下图中,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,在表面皿中心处放置2小粒KMnO4晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见KMnO4晶体很快溶解,并产生气体。
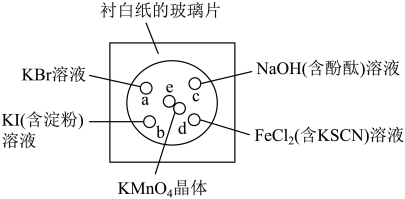
(1) 完成本实验中制取Cl2的化学方程式:
__ KMnO4+____ HCl(浓)—___ KCl +_____ MnCl2 + ____ Cl2↑+__ ______ .
如该反应中消耗还原剂的物质的量为8mol,则电子转移数目为________ .
⑵b处的实验现象为___________ ;c处的实验现象为____________
⑶d处反应的离子方程式为_______ 、_______
⑷通过该实验能比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱,其氧化性由强到弱的顺序是__ 。

(1) 完成本实验中制取Cl2的化学方程式:
如该反应中消耗还原剂的物质的量为8mol,则电子转移数目为
⑵b处的实验现象为
⑶d处反应的离子方程式为
⑷通过该实验能比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱,其氧化性由强到弱的顺序是
您最近一年使用:0次
2019-06-19更新
|
233次组卷
|
2卷引用:沪科版高中化学拓展课程第5章《非金属元素》检测题
3 . 将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
① 反应Ⅰ的化学方程式是________ 。
② 反应Ⅱ:____ + 1 H2S == ____ Fe2+ + ____ S↓ + ____ (将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______ 。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。
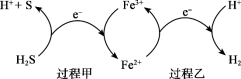
过程甲、乙中,氧化剂分别是______ 。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:
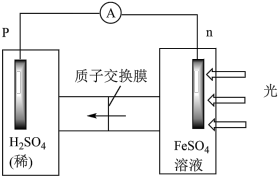
ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______ (写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______ 。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。
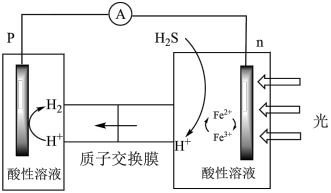
进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________ 。
(1)H2S的转化
| Ⅰ | 克劳斯法 |  |
| Ⅱ | 铁盐氧化法 | 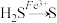 |
| Ⅲ | 光分解法 | 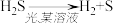 |
① 反应Ⅰ的化学方程式是
② 反应Ⅱ:
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。

过程甲、乙中,氧化剂分别是
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:

ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。

进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:
您最近一年使用:0次
2019-05-15更新
|
871次组卷
|
4卷引用:沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题1



