1 . R2O 在酸性溶液中与MnO
在酸性溶液中与MnO 反应,反应产物为RO2、Mn2+、H2O。已知反应中氧化剂与还原剂的物质的量之比为2∶5,则x的值为
反应,反应产物为RO2、Mn2+、H2O。已知反应中氧化剂与还原剂的物质的量之比为2∶5,则x的值为
 在酸性溶液中与MnO
在酸性溶液中与MnO 反应,反应产物为RO2、Mn2+、H2O。已知反应中氧化剂与还原剂的物质的量之比为2∶5,则x的值为
反应,反应产物为RO2、Mn2+、H2O。已知反应中氧化剂与还原剂的物质的量之比为2∶5,则x的值为| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2022-11-04更新
|
1912次组卷
|
24卷引用:重庆市第八中学2020-2021学年高一上学期第二次月考化学试题
重庆市第八中学2020-2021学年高一上学期第二次月考化学试题天津市和平区耀华中学2019-2020学年高一上学期第一次月考化学试题天津市耀华中学2020-2021学年高一上学期第一次月考化学试题湖南省常德市一中2020-2021学年高一上学期10月月考化学试题吉林省长春市第八中学2020-2021学年高一上学期第一次月考化学试题浙江省龙港市第二高级中学2020-2021学年高一上学期第一次月考化学试题吉林省长春市长春外国语学校2020-2021学年高一上学期期中考试化学(理科)试题(已下线)【浙江新东方】19黑龙江省哈尔滨市师大附中2020-2021学年高一上学期期末考试化学试题黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高一10月月考化学试题天津市和平区耀华中学2021-2022学年高一上学期9月月考化学试题本章复习提升天津市南开大学附属中学2022-2233学年高一上学期阶段检测化学试题(一)辽宁省铁岭市清河高级中学2022-2023学年高一上学期第一次月考化学试题吉林省德惠市实验中学2022-2023学年高一上学期第一次月考化学试题江苏省锡山高级中学2022-2023学年高一上学期期中考试化学试题江苏省盐城市响水中学2022-2023学年高一上学期期中考试化学试题江苏省徐州市运河中学2022-2023学年高一上学期第二次学情调研化学试题安徽省淮北市第一中学2022-2023学年高一上学期期末考试化学试题内蒙古呼和浩特市第二中学致远级部2022-2023学年高一上学期期末考试化学试题 甘肃省民勤县第一中学2022-2023学年 高一下学期开学考试化学试题湖北省十堰市部分重点中学2022-2023学年高一下学期3月联考化学试题河北省石家庄市第二十七中学2023-2024学年高一上学期第一次阶段考试化学试题北京市清华大学附属中学2023-2024学年高一上学期12月统练二化学试题
2 . 金属Mn与 反应的现象如下:
反应的现象如下:
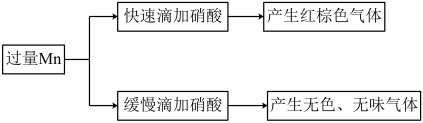
已知:经检验,反应后的溶液中含有 ;氧化性:
;氧化性: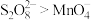 。
。
下列说法错误的是
 反应的现象如下:
反应的现象如下:
已知:经检验,反应后的溶液中含有
 ;氧化性:
;氧化性: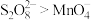 。
。下列说法错误的是
A.缓慢滴加产生的气体中,可能含有 ,一定不含 ,一定不含 |
| B.快速滴加实验中,硝酸表现酸性、强氧化性 |
C.向缓慢滴加实验所得溶液中加入 ,溶液变为紫红色 ,溶液变为紫红色 |
D.收集快速滴加过程中获得的红棕色气体,干燥后会得到纯净的 |
您最近一年使用:0次
名校
解题方法
3 . 下列实验的实验操作和现象及所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 在氨水中滴加少量硫酸铜溶液,产生蓝色沉淀 | Cu(OH)2为蓝色难溶于水的沉淀 |
| B | 向某黄色溶液中加入淀粉-KI溶液,溶液呈蓝色 | 原溶液中一定含有Fe3+ |
| C | 常温下,测定NH4HCO3溶液酸碱性,测得溶液呈碱性 | H2CO3为弱酸 |
| D | 向对甲基苯酚溶液中滴加足量高锰酸钾溶液,溶液褪色 | 对甲基苯酚被氧化,生成对羟基苯甲酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-04更新
|
619次组卷
|
4卷引用:重庆市南开中学2022-2023学年高三上学期第一次质检化学试题
名校
解题方法
4 . 有下列三个在溶液中发生的氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
请根据上述反应分析推断后回答下列问题:
(1)FeCl3、I2、Cl2、K2Cr2O7的氧化性由强到弱依次是___________ 。
(2)Cr2O 、I-在强酸性溶液中能否大量共存?
、I-在强酸性溶液中能否大量共存?___________ (填“能”或“不能”),理由是___________ 。
(3)在酸性溶液中存在大量的I-,则Cr2O 、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是
、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是___________ 。
(4)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O 还原成Cr3+,反应的离子方程式为
还原成Cr3+,反应的离子方程式为___________ 。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
请根据上述反应分析推断后回答下列问题:
(1)FeCl3、I2、Cl2、K2Cr2O7的氧化性由强到弱依次是
(2)Cr2O
 、I-在强酸性溶液中能否大量共存?
、I-在强酸性溶液中能否大量共存?(3)在酸性溶液中存在大量的I-,则Cr2O
 、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是
、Fe3+、Fe2+、Cl-中能与I-大量共存的离子是(4)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O
 还原成Cr3+,反应的离子方程式为
还原成Cr3+,反应的离子方程式为
您最近一年使用:0次
2021-08-06更新
|
1244次组卷
|
10卷引用:重庆市南开中学2020-2021学年高一上学期期中(半期)考试化学试题
重庆市南开中学2020-2021学年高一上学期期中(半期)考试化学试题第3课时 氧化还原反应的基本规律和配平(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)江西省奉新县第一中学2021-2022学年高一上学期第一次月考化学试题河南省驻马店市新蔡县第一高级中学2021-2022学年高一上学期10月月考化学试题(已下线)1.3.2 氧化剂与还原剂 氧化还原反应规律-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)天津市第二十五中学2022-2023学年高一上学期第一次阶段检测化学试题内蒙古乌兰察布市2022-2023学年高一上学期期中考试化学试题河南省开封市尉氏三中南校区2021-2022学年高一上学期月考化学试题湖南省株洲市第二中学2023-2024学年高一上学期第二次适应性检测化学试题 黑龙江省牡丹江市第二高级中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
5 . 已知反应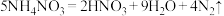 ,下列说法不正确的是
,下列说法不正确的是
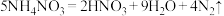 ,下列说法不正确的是
,下列说法不正确的是| A.NH4NO3既是氧化剂又是还原剂 |
| B.反应中被氧化与被还原的N原子的物质的量之比是5:3 |
C.若反应中转移3mol ,则氧化产物比还原产物多5.6g ,则氧化产物比还原产物多5.6g |
| D.N2是氧化产物,HNO3是还原产物 |
您最近一年使用:0次
2022-04-05更新
|
568次组卷
|
2卷引用:重庆市南开中学校2021--2022学年高一上学期期末化学试题
名校
解题方法
6 . 下列表示对应化学反应的离子方程式正确的是
A. 加入过量的 加入过量的 溶液: 溶液: |
B.向 溶液中加少量的 溶液中加少量的 溶液: 溶液: |
C.将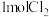 通入到含 通入到含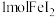 的溶液: 的溶液: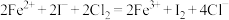 |
D. 溶液与 溶液与 溶液等体积混合: 溶液等体积混合: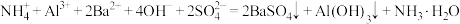 |
您最近一年使用:0次
名校
解题方法
7 . 工业上用发烟HClO4将潮湿的CrC13氧化为棕色的烟[CrO2(C1O4)2],来除去Cr(Ⅲ),HClO4中部分氯元素转化为最低价态。下列说法错误的是( )
| A.CrO2(C1O4)2中Cr元素显+6价 |
| B.HClO4属于强酸,该反应还生成了另一种强酸 |
| C.该反应中,参加反应的氧化剂与氧化产物的物质的量之比为3:8 |
D.该反应离子方程式为19ClO +8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O +8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O |
您最近一年使用:0次
2020-06-28更新
|
1863次组卷
|
12卷引用:重庆市南开中学校2021--2022学年高一上学期期末化学试题
重庆市南开中学校2021--2022学年高一上学期期末化学试题山东省济南二中2020届高三线上检测化学试题山东省日照市五莲县2020届高三上学期10月模块诊断性测试化学试题山东省滨州市2020届高三第三次模拟考试化学试题(已下线)专题04 氧化还原反应-2020年高考真题和模拟题化学分项汇编(已下线)易错05 氧化还原反应概念及规律-备战2021年高考化学一轮复习易错题湖南省长沙市雅礼中学2021届高三上学期第一次月考化学试题河北省石家庄精英中学2021届高三二轮专题一阶段考试化学试卷(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)陕西省西安市长安区第一中学2021-2022学年高二下学期期末考试化学试题黑龙江省大庆铁人中学2022-2023学年高一上学期期末考试化学试题(已下线)第5讲 氧化还原反应方程式的配平与计算
2019高一·浙江·专题练习
名校
解题方法
8 . 已知反应:
①2BrO +Cl2=Br2+2ClO
+Cl2=Br2+2ClO ;
;
②5Cl2+I2+6H2O=2HIO3+10HCl;
③ClO +5Cl-+6H+=3Cl2↑+3H2O。
+5Cl-+6H+=3Cl2↑+3H2O。
下列微粒氧化性强弱顺序正确的是
①2BrO
 +Cl2=Br2+2ClO
+Cl2=Br2+2ClO ;
;②5Cl2+I2+6H2O=2HIO3+10HCl;
③ClO
 +5Cl-+6H+=3Cl2↑+3H2O。
+5Cl-+6H+=3Cl2↑+3H2O。下列微粒氧化性强弱顺序正确的是
A.ClO >BrO >BrO >HIO3>Cl2 >HIO3>Cl2 | B.BrO >Cl2>ClO >Cl2>ClO >HIO3 >HIO3 |
C.BrO >ClO >ClO >Cl2>HIO3 >Cl2>HIO3 | D.Cl2>BrO >ClO >ClO >HIO3 >HIO3 |
您最近一年使用:0次
2022-11-01更新
|
906次组卷
|
39卷引用:重庆市第七中学校2020-2021学年高一上学期12月月考化学试题
重庆市第七中学校2020-2021学年高一上学期12月月考化学试题(已下线)【新东方】2019新中心五地019高中化学安徽省芜湖市2019—2020学年高一上学期期末质量监测化学试题湖南省长沙市长郡中学2019-2020学年高一四选二科目期中联考化学试题(已下线)【新东方】2020-57陕西省西安市第一中学2018-2019学年高一上学期期末考试化学试题宁夏贺兰县景博中学2019-2020学年高一上学期期中考试化学试题(已下线)第二单元 化学物质的变化测试题-2021年高考化学一轮复习名师精讲练(已下线)1.3.2 氧化剂还原剂(精练)——2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)黑龙江省大庆市东风中学2020-2021学年高一上学期第一次阶段考试化学试题天津市第二十一中学2020-2021学年高一上学期期中检测化学试题黑龙江省鹤岗市第一中学2020-2021学年高一上学期期中考试化学试题湖南省娄底市第一中学2020-2021学年高一上学期期中考试化学试题河南省商丘市第一高级中学2020-2021学年高一上学期期中考试化学试题黑龙江省哈尔滨市南岗区哈尔滨市第三十二中学2020-2021学年高一上学期期中考试化学试题宁夏银川市长庆高级中学2020-2021学年高一上学期期末考试化学试题湖南省长沙市明达中学2019-2020学年高一下学期期末考试化学试题青海省湟川中学2020-2021学年高一下学期开学考试化学试题云南省楚雄中学2020-2021学年高一下学期4月月考化学试题吉林省吉林市第二中学2020-2021学年高二下学期期末考试化学试题湖南省邵阳邵东市第一中学2021-2022学年高一上学期期中考试化学试题(已下线)衔接点12 氧化剂和还原剂-2022年初升高化学无忧衔接?云南省德宏州2020-2021学年高一上学期期末统一监测化学试题浙江省金华市曙光学校2021-2022学年高一上学期10月月考化学试题黑龙江省牡丹江穆棱市第二中学2021-2022学年高一上学期期末考试化学试题辽宁省大连市二十四中2021-2022学年高一上学期期中化学试题 江苏省天一中学2021-2022学年高一上学期期中考试化学试题天津市实验中学2022-2023学年高一上学期学情评估(一)化学试题黑龙江省哈尔滨市第七十三中学校2022-2023学年高三上学期第一次月考化学试题黑龙江省哈尔滨市第七十三中学校2022-2023学年高一上学期第一次月考化学试题甘肃省天水市第一中学2022-2023学年高一上学期期中考试化学试题内蒙古乌兰察布市2022-2023学年高一上学期期中考试化学试题河南省宋基信阳实验中学2022-2023学年高三上学期11月月考化学试题广东省中山市小榄中学2022-2023学年高三上学期第一次月考化学试题广东省普宁市华侨中学2022-2023学年高一上学期(11月)期中考试化学试题【精品卷】1.3.2 氧化剂和还原剂课堂例题-人教版2023-2024学年必修第一册甘肃省天水市第一中学2023-2024学年高一上学期10月月考化学试题吉林省长春外国语学校2023-2024学年高一上学期11月期中考试化学试题
名校
9 . NA为阿伏加德罗常数的值,下列有关说法正确的是
| A.18 g D2O 中含有的质子数为 10 NA |
B.14.2 g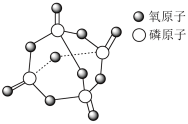 含 σ 键的数目为 0.4 NA 含 σ 键的数目为 0.4 NA |
| C.向FeI2溶液中通入适量 Cl2,当有 1 mol Fe2+被氧化时,共转移电子的数目为 NA |
D.反应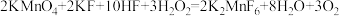 中,每有 1 mol KMnO4 被还原,转移电子数为 3NA 中,每有 1 mol KMnO4 被还原,转移电子数为 3NA |
您最近一年使用:0次
2023-08-19更新
|
437次组卷
|
2卷引用:重庆市第八中学2023-2024学年高三上学期暑期阶段性测试化学试题
名校
10 . 利用废旧白铁皮(含Fe、Zn、Fe2O3、ZnO)制备磁性Fe3O4胶体流程如图:

已知:锌及其化合物的性质与铝及其化合物的性质具有一定的相似性。
请回答:
(1)步骤Ⅰ碱溶的目的是去除油污,以及溶解镀锌层,写出NaOH溶液与ZnO反应的化学方程式_____ 。
(2)“部分氧化”阶段,ClO 被Fe2+还原为Cl-,该反应的离子方程式是
被Fe2+还原为Cl-,该反应的离子方程式是_____ 。
(3)经测定溶液B中Fe2+、Fe3+的物质的量之比是1∶2。检验其中Fe2+可选用的试剂是_____ (填字母)。
(4)用______ 效应可以确定溶液B中是否产生了Fe3O4胶体。
(5)步骤Ⅵ制备Fe3O4胶体装置如图1所示:

①持续通入N2的作用是______ 。
②实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和图2装置(净化装置略去),选出一种可行的方法,写出化学方程式_____ 。
可供选择的试剂:CuO(s)、NH3(g)、Cl2(g)、O2(g)、饱和NaNO2(aq)、饱和NH4Cl(aq)


已知:锌及其化合物的性质与铝及其化合物的性质具有一定的相似性。
请回答:
(1)步骤Ⅰ碱溶的目的是去除油污,以及溶解镀锌层,写出NaOH溶液与ZnO反应的化学方程式
(2)“部分氧化”阶段,ClO
 被Fe2+还原为Cl-,该反应的离子方程式是
被Fe2+还原为Cl-,该反应的离子方程式是(3)经测定溶液B中Fe2+、Fe3+的物质的量之比是1∶2。检验其中Fe2+可选用的试剂是
| A.NaOH溶液 | B.KSCN溶液 | C.KMnO4溶液 | D.K3[Fe(CN)6]溶液 |
(5)步骤Ⅵ制备Fe3O4胶体装置如图1所示:

①持续通入N2的作用是
②实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和图2装置(净化装置略去),选出一种可行的方法,写出化学方程式
可供选择的试剂:CuO(s)、NH3(g)、Cl2(g)、O2(g)、饱和NaNO2(aq)、饱和NH4Cl(aq)

您最近一年使用:0次
2023-01-15更新
|
427次组卷
|
2卷引用: 重庆市第一中学校2022-2023学年高一上学期期末考试化学试题



