名校
解题方法
1 . 硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。以硫酸工业的尾气、氨水、石灰石、焦炭及氯化钾为原料可以合成有重要用途的硫化钙、硫酸钾、氯化铵、亚硫酸铵等物质。合成路线如下:
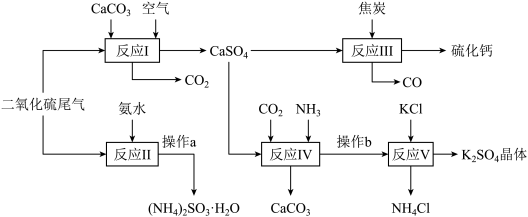
完成下列填空:
(1)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏,且反应过程中96%的硫转化为石膏,则可生产石膏______ t。
(2)操作a中,必须的操作步骤有蒸发、___________ 、___________ 等;
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为__________ ;
(4)写出反应Ⅳ的方程式______________ ;操作b所得滤液中阳离子的检验方法是________________ 。
(5)反应Ⅴ在25℃,40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是___________ ;
(6)该生产过程中可以循环使用的物质是_______________ 。

完成下列填空:
(1)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏,且反应过程中96%的硫转化为石膏,则可生产石膏
(2)操作a中,必须的操作步骤有蒸发、
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为
(4)写出反应Ⅳ的方程式
(5)反应Ⅴ在25℃,40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是
(6)该生产过程中可以循环使用的物质是
您最近一年使用:0次
名校
2 . 工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。
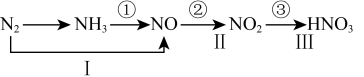
(1)写出N2的一种用途_____________________ 。
(2)工业合成NH3的化学方程式为______________________ 。
(3)写出工业制硝酸第③步反应化学方程式_____________________ 。
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(ⅰ)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:____________ 。该反应中发生氧化反应的物质是_______ ,1 mol氧化剂_________ (填“得到”或“失去”)_______ mol电子。
(ⅱ)64.0 g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4 L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是( )
(ⅲ)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3+______ 
______ + ______ + N2O↑ + H2O
并配平其对应的离子方程式:__ Fe2++__ NO3-+__ H+ =__ Fe3++__ N2O↑+__ H2O

(1)写出N2的一种用途
(2)工业合成NH3的化学方程式为
(3)写出工业制硝酸第③步反应化学方程式
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(ⅰ)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:
(ⅱ)64.0 g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4 L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是
(ⅲ)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3+

并配平其对应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
575次组卷
|
2卷引用:2014-2015福建省南安第一中学高一下学期期中考试化学试卷
名校
解题方法
3 . 碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下。
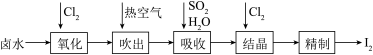
(1)“氧化”时若Cl2过量,则会将I2氧化为HIO3,写出该反应的化学方程式_____________ 。
(2)“吹出”在吹出塔中进行,含碘卤水从_______ (填“塔顶”或“塔底”)进入, 请解释这样做的原因_______________________
(3)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为_______ ;为进一步分离I2和CCl4,向其中加入NaOH溶液与I2反应,生成的I-、IO 进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO
进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO 的物质的量之比为
的物质的量之比为_______ 。
(4)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为 IO ,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2
,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2______ g。

(1)“氧化”时若Cl2过量,则会将I2氧化为HIO3,写出该反应的化学方程式
(2)“吹出”在吹出塔中进行,含碘卤水从
(3)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为
 进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO
进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO 的物质的量之比为
的物质的量之比为(4)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为 IO
 ,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2
,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2
您最近一年使用:0次
4 . 溴化锂是一种高效的水汽吸收剂,其一种绿色工业合成工艺如下(部分操作和条件已略去)。

已知:碳酸锂微溶于水,水溶液显碱性。
(1)Br2的电子式是______ 。
(2)合成过程中发生的反应如下,请写出ii反应的化学方程式并将iii补充完整。
ⅰ. Br2 +H2O HBr +HBrO;
HBr +HBrO;
ⅱ._____ ;
ⅲ. 3LiBrO + CO(NH2)2(尿素)=3LiBr+_____ 。
(3)LiBrO3是生产过程中的副产物。
①用化学方程式表示生成改副产物的原因:______ 。
②为了提高原料的利用率,减少副产物的生成,必须调控体系的pH在3~5之间,通过合理的加料方法来实现:将碳酸锂粉末溶解于冷的溴水中至饱和,并一次性加入尿素,然后再______ ,直到尿素完全转化。
③常用硫脲除去LiBrO3,反应的化学方程式是4LiBrO3 +3CS(NH2)2(硫脲) +3H2O=4LiBr +3CO(NH2)2 +3H2SO4 ,选用硫脲除杂的优点是_______ ;缺点是引入新杂质且溶液酸性增强,为解决该问题需要加入的试剂是_______ 。

已知:碳酸锂微溶于水,水溶液显碱性。
(1)Br2的电子式是
(2)合成过程中发生的反应如下,请写出ii反应的化学方程式并将iii补充完整。
ⅰ. Br2 +H2O
 HBr +HBrO;
HBr +HBrO;ⅱ.
ⅲ. 3LiBrO + CO(NH2)2(尿素)=3LiBr+
(3)LiBrO3是生产过程中的副产物。
①用化学方程式表示生成改副产物的原因:
②为了提高原料的利用率,减少副产物的生成,必须调控体系的pH在3~5之间,通过合理的加料方法来实现:将碳酸锂粉末溶解于冷的溴水中至饱和,并一次性加入尿素,然后再
③常用硫脲除去LiBrO3,反应的化学方程式是4LiBrO3 +3CS(NH2)2(硫脲) +3H2O=4LiBr +3CO(NH2)2 +3H2SO4 ,选用硫脲除杂的优点是
您最近一年使用:0次
5 . 氧锰八面体纳米棒(OMS-2)是一种新型的环保催化剂。用软锰矿和黄铁矿(主要成分分别为MnO2、FeS2)合成OMS-2的工艺流程如下:
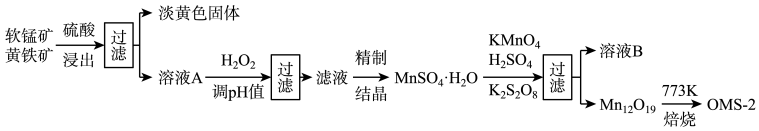
(1)FeS2中硫元素的化合价是_________ 。“调pH并过滤”主要除去______ 元素。
(2)Mn12O19中氧元素化合价均为-2价,锰元素的化合价有两种,则Mn (Ⅲ)、Mn (Ⅳ) 物质的量之比为_______________ 。生产过程中的原料KMnO4、K2S2O8、MnSO4·H2O按物质的量比1:1:5反应,产物中硫元素全部以SO 的形式存在,该反应的离子方程式为
的形式存在,该反应的离子方程式为__________________________ 。
(3)溶液B可进一步分离出两种主要化合物,一种可在该工艺中循环使用,化学式是____________ ;另一种为盐类,在农业生产中可用作___________________________ 。
(4)OMS-2是一种纳米级的分子筛。分别用OMS-2和MnOx对甲醛进行催化氧化,在相同时间内甲醛转化率和温度的关系如图:
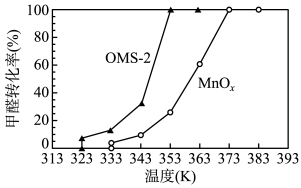
由图可知,OMS-2与MnOx相比,催化效率较高是____________________ ,原因是________________ 。
(5)甲醛(HCHO)在OMS-2催化氧化作用下生成CO2和H2O,现利用OMS-2对某密闭空间的甲醛进行催化氧化实验,实验开始时,该空间内甲醛含量为1.22mg/L,CO2含量为0.590mg/L,一段时间后测得CO2含量升高至1.25mg/L,该实验中甲醛的转化率为_______________________ 。

(1)FeS2中硫元素的化合价是
(2)Mn12O19中氧元素化合价均为-2价,锰元素的化合价有两种,则Mn (Ⅲ)、Mn (Ⅳ) 物质的量之比为
 的形式存在,该反应的离子方程式为
的形式存在,该反应的离子方程式为(3)溶液B可进一步分离出两种主要化合物,一种可在该工艺中循环使用,化学式是
(4)OMS-2是一种纳米级的分子筛。分别用OMS-2和MnOx对甲醛进行催化氧化,在相同时间内甲醛转化率和温度的关系如图:

由图可知,OMS-2与MnOx相比,催化效率较高是
(5)甲醛(HCHO)在OMS-2催化氧化作用下生成CO2和H2O,现利用OMS-2对某密闭空间的甲醛进行催化氧化实验,实验开始时,该空间内甲醛含量为1.22mg/L,CO2含量为0.590mg/L,一段时间后测得CO2含量升高至1.25mg/L,该实验中甲醛的转化率为
您最近一年使用:0次
名校
6 . 碘及其化合物主要用于医药、照相及染料等。碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下:
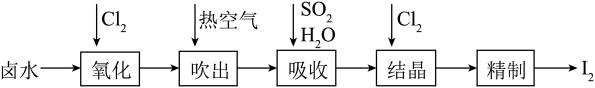
回答下列问题:
(1)“氧化”时,Cl2过量会将I2氧化为HIO3,写出生成HIO3的化学方程式_________ ;
(2)“吹出”在吹出塔中进行,含碘卤水从_________ (填“塔顶”或“塔底”,下同)进入,热空气从_________ 进入,理由为_________ ;
(3)吸收塔应选择耐酸材料,原因是_________ ;
(4)结晶时,发生反应的离子方程式为_________ ;
(5)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为_________ ;为进一步分离I2和CCl4,向其中加入NaOH溶液与I2反应,生成的I-、 进入水溶液;分液后再酸化,即得粗碘.加入NaOH后溶液中I-、
进入水溶液;分液后再酸化,即得粗碘.加入NaOH后溶液中I-、 的物质的量之比为
的物质的量之比为_________ ;
(6)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为 ,再将其与卤水按一定比例混合、酸化制取粗碘,处理含I-为254mg/L的卤水1m3,理论上需20%的H2O2
,再将其与卤水按一定比例混合、酸化制取粗碘,处理含I-为254mg/L的卤水1m3,理论上需20%的H2O2_________ g。

回答下列问题:
(1)“氧化”时,Cl2过量会将I2氧化为HIO3,写出生成HIO3的化学方程式
(2)“吹出”在吹出塔中进行,含碘卤水从
(3)吸收塔应选择耐酸材料,原因是
(4)结晶时,发生反应的离子方程式为
(5)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为
 进入水溶液;分液后再酸化,即得粗碘.加入NaOH后溶液中I-、
进入水溶液;分液后再酸化,即得粗碘.加入NaOH后溶液中I-、 的物质的量之比为
的物质的量之比为(6)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为
 ,再将其与卤水按一定比例混合、酸化制取粗碘,处理含I-为254mg/L的卤水1m3,理论上需20%的H2O2
,再将其与卤水按一定比例混合、酸化制取粗碘,处理含I-为254mg/L的卤水1m3,理论上需20%的H2O2
您最近一年使用:0次
2016-12-09更新
|
370次组卷
|
3卷引用:2016届山西省临汾一中高三下3月月考理综化学试卷



