2021高一·全国·专题练习
1 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
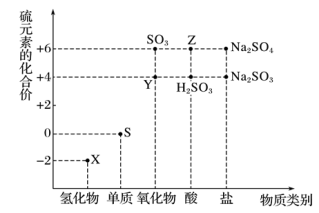
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为___________ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
您最近一年使用:0次
2 . FeBr2溶液中通入过量Cl2:_______
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
3 . 如将少量Cl2通入到FeBr2溶液中,由于Fe2+ 的还原性大于Br- 的还原性,所以通入少量Cl2后,先氧化Fe2+ ,其离子方程式为_______ ,若Cl2过量时,把Fe2+ 氧化完后,才继续氧化Br- ,则离子方程式为_______
您最近一年使用:0次
2021高三·全国·专题练习
名校
解题方法
4 . 利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是
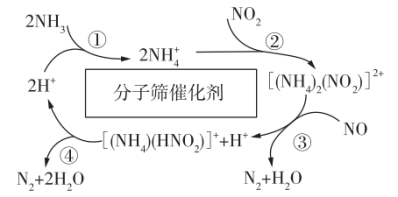

| A.过程①~④均为氧化还原反应 |
B.上述历程的总反应为2NH3+NO+NO2 2N2+3H2O 2N2+3H2O |
C.NH3、NH 、H2O中的质子数、电子数相同 、H2O中的质子数、电子数相同 |
| D.过程④中,生成11.2 LN2时转移的电子数为1.5NA |
您最近一年使用:0次
2021-12-24更新
|
431次组卷
|
3卷引用:专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练
(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练河南省南阳市第一中学校2022-2023学年高二上学期开学考试化学试题重庆市2023届高三上学期11月质量检测化学试题
14-15高三上·北京石景山·期末
名校
解题方法
5 . 海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO 、HCO
、HCO 、CO
、CO 等,火力发电时排放的烟气可用海水脱硫,其工艺流程如图所示:
等,火力发电时排放的烟气可用海水脱硫,其工艺流程如图所示:
 、HCO
、HCO 、CO
、CO 等,火力发电时排放的烟气可用海水脱硫,其工艺流程如图所示:
等,火力发电时排放的烟气可用海水脱硫,其工艺流程如图所示: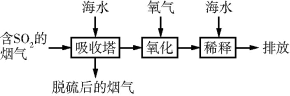
A.海水pH约为8的原因主要是海水中含有CO 、HCO 、HCO |
B.吸收塔中发生的反应有SO2+H2O H2SO3 H2SO3 |
C.氧化主要是氧气将SO 、HSO 、HSO 氧化为SO 氧化为SO |
D.经稀释排放出的废水中SO 的浓度与海水中的相同 的浓度与海水中的相同 |
您最近一年使用:0次
2021-12-24更新
|
270次组卷
|
13卷引用:专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练
(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练福建2020届高三化学总复习专题训练——无极工艺流程选择填空题(已下线)2014届北京市石景山区高三上学期期末考试化学试卷(已下线)2014高考名师推荐化学资源的综合应用辽宁省沈阳市东北育才学校2018届高三上学期第一次模拟考试化学试题湖南省长郡中学2018届高三月考试题(二)化学试题1辽宁省沈阳市东北育才学校2018届高三10月月考化学试题2017-2018学年人教新版高一化学必修一第四章第三节基础题【全国百强校】北京市北京师范大学附属中学2017-2018学年高二下学期期末考试化学试题【全国百强校】北京市北京四中2019届高三上学期期中考试化学试题广东省北大附中深圳南山分校2020届高三上学期期中考试化学试题中国人民大学附属中学2023-2024学年高三下学期化学练习62024年中国人民大学附属中学高三下学期高考化学模拟练习试卷(六)
2021高三·全国·专题练习
解题方法
6 . Fe2(SO4)3溶液与Cu粉混合: 。( )
。( )
 。( )
。( )
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
7 . 向稀Fe(NO3)2溶液中加入稀盐酸:Fe2++2H++ =Fe3++NO↑+H2O。( )
=Fe3++NO↑+H2O。( )
 =Fe3++NO↑+H2O。( )
=Fe3++NO↑+H2O。( )
您最近一年使用:0次
8 . 已知还原性:SO >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
 >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是A.当a≥b时,发生的离子反应为SO +Cl2+H2O=SO +Cl2+H2O=SO +2H++2Cl- +2H++2Cl- |
B.当5a=4b时,发生的离子反应为4SO +2I-+5Cl2+4H2O=4SO +2I-+5Cl2+4H2O=4SO +I2+8H++10Cl- +I2+8H++10Cl- |
C.当a≤b≤ a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol |
D.当a<b< a时,溶液中SO a时,溶液中SO 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b |
您最近一年使用:0次
2021-12-24更新
|
635次组卷
|
8卷引用:解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)浙江省2018版考前特训(2017年10月)学考70快练:9 定量离子方程式的书写判断与计算(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)辽宁省抚顺市2016-2017学年高二下学期期末考试化学试题2016年10月浙江省普通高校招生选考科目考试化学试题(已下线)【2023】【高一下】【其他】【杭二中-期中复习卷】【高中化学】【邵威宏收集】浙江省湖州市吴兴高级中学2023-2024学年高一上学期12月月考化学试题
9 . 指定条件下,下列物质转化不能实现的是
A.SO2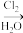 H2SO4 H2SO4 | B.FeS2 SO3 SO3 |
C.SO2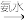 NH4HSO3 NH4HSO3 | D.NH4HSO3 (NH4)2SO4 (NH4)2SO4 |
您最近一年使用:0次
2021-12-14更新
|
412次组卷
|
4卷引用:解密07 非金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)江苏省南通市海门区2021-2022学年高三第二次诊断测试化学试题(已下线)黄金卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)江苏省苏州市重点中学2022-2023学年高三上学期10月月考化学试题
10 . 实验室可通过置换反应完成卤素单质活泼性比较的实验。某实验小组设计了装置如图,回答下列问题:
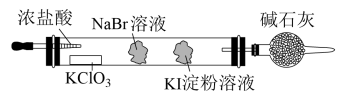
(1)已知:常温下KClO3与浓盐酸反应可制取氯气,反应如下。配平该化学方程式,标出电子转移的方向和数目。
反应①___________KClO3 +___________HCl(浓)=___________KCl + ___________Cl2↑+ ___________H2O___________
该反应中氧化剂为___________ ,被还原的元素是___________ 。
(2)该装置中,吸有KI淀粉溶液的棉球颜色变为___________ 。吸有NaBr溶液的棉球中发生反应的离子方程式为___________ 。
(3)由反应现象能否得出活泼性Br2>I2的结论?回答并说明理由___________ 。
(4)实验室还可通过以下反应制取氯气:
反应② 2KMnO4 +16HCl=2KCl + 2MnCl2 +5Cl2↑+ 8H2O;
反应③ MnO2 +4HCl(浓) MnCl2 +Cl2↑+ 2H2O;
MnCl2 +Cl2↑+ 2H2O;
若要制得相同质量的氯气,反应②和③中电子转移的数目之比为___________ 。
(5)通过反应①~③,比较反应中氧化剂的氧化性强弱___________ ,(用“>”、“<”或“=”连接)说明判断依据:___________ 。
(6)通过反应①~③,可以知道HCl的还原性强弱与___________ 、___________ 等因素有关。

(1)已知:常温下KClO3与浓盐酸反应可制取氯气,反应如下。配平该化学方程式,标出电子转移的方向和数目。
反应①___________KClO3 +___________HCl(浓)=___________KCl + ___________Cl2↑+ ___________H2O
该反应中氧化剂为
(2)该装置中,吸有KI淀粉溶液的棉球颜色变为
(3)由反应现象能否得出活泼性Br2>I2的结论?回答并说明理由
(4)实验室还可通过以下反应制取氯气:
反应② 2KMnO4 +16HCl=2KCl + 2MnCl2 +5Cl2↑+ 8H2O;
反应③ MnO2 +4HCl(浓)
 MnCl2 +Cl2↑+ 2H2O;
MnCl2 +Cl2↑+ 2H2O;若要制得相同质量的氯气,反应②和③中电子转移的数目之比为
(5)通过反应①~③,比较反应中氧化剂的氧化性强弱
(6)通过反应①~③,可以知道HCl的还原性强弱与
您最近一年使用:0次



