名校
解题方法
1 . NaCl是一种化工原料,可以制备多种物质,如图所示。
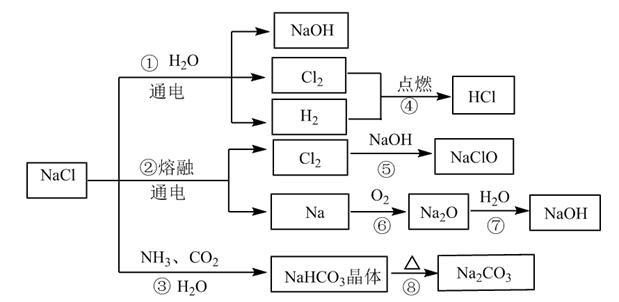
请回答下列问题:
(1)图所列物质中属于电解质的有___________ 种,转化反应中属于氧化还原反应的有___________ (填图中序号)
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是___________ 。
(3)反应④的现象是___________ ;反应⑤的化学方程式为___________ 。
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。该同学从中取出100mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=___________ mol/L(结果保留两位小数);“84消毒液”不能与“洁厕灵(主要成分是HCl)”混合使用,否则会产生黄绿色的有毒气体引起安全事故,其反应的离子方程式是___________ 。

请回答下列问题:
(1)图所列物质中属于电解质的有
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是
(3)反应④的现象是
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。该同学从中取出100mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=
您最近半年使用:0次
2021-11-13更新
|
356次组卷
|
2卷引用:辽宁省实验中学2021-2022学年高一上学期11月期中阶段测试化学试题
名校
2 . 标准状况下,将体积比为 的
的 、
、 、
、 在密闭容器中用电火花点燃充分反应,恢复到原状态后,形成溶液的质量分数为
在密闭容器中用电火花点燃充分反应,恢复到原状态后,形成溶液的质量分数为_______ (用小数表示,保留三位小数)。
 的
的 、
、 、
、 在密闭容器中用电火花点燃充分反应,恢复到原状态后,形成溶液的质量分数为
在密闭容器中用电火花点燃充分反应,恢复到原状态后,形成溶液的质量分数为
您最近半年使用:0次
名校
3 . 下图是化学实验室浓盐酸试剂标签上的部分内容。
(1)写出工业上制 的化学方程式
的化学方程式___________ ,在实验室中进行该反应,现象是___________ 。
(2)该盐酸的物质的量浓度为___________ 。
(3)同学计划用该浓盐酸配制 的稀盐酸,现实验需要稀盐酸
的稀盐酸,现实验需要稀盐酸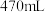 ,可供选用的仪器有:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E.玻璃棒。
,可供选用的仪器有:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E.玻璃棒。
①配制稀盐酸时,选择的仪器有:___________ (填序号),还缺少的仪器有___________ 。
②经计算,配制 的稀盐酸需要用量筒量取上述浓盐酸的体积为
的稀盐酸需要用量筒量取上述浓盐酸的体积为___________  。
。
③测定所配制的稀盐酸,发现其浓度大于 ,引起误差的原因可能是
,引起误差的原因可能是___________ (填序号)。
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入容量瓶
B.转移溶液后,未洗涤烧杯和玻璃棒
C.定容时俯视容量瓶刻度线
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
| 盐酸 分子式:  相对分子质量:36.5 密度约   的质量分数:36.5% 的质量分数:36.5% |
 的化学方程式
的化学方程式(2)该盐酸的物质的量浓度为
(3)同学计划用该浓盐酸配制
 的稀盐酸,现实验需要稀盐酸
的稀盐酸,现实验需要稀盐酸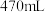 ,可供选用的仪器有:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E.玻璃棒。
,可供选用的仪器有:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E.玻璃棒。①配制稀盐酸时,选择的仪器有:
②经计算,配制
 的稀盐酸需要用量筒量取上述浓盐酸的体积为
的稀盐酸需要用量筒量取上述浓盐酸的体积为 。
。③测定所配制的稀盐酸,发现其浓度大于
 ,引起误差的原因可能是
,引起误差的原因可能是A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入容量瓶
B.转移溶液后,未洗涤烧杯和玻璃棒
C.定容时俯视容量瓶刻度线
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
您最近半年使用:0次
4 . 下图是化学实验室浓盐酸试剂标签上的部分内容。
(1)写出工业上制 的化学方程式
的化学方程式___________ ,在实验室中进行该反应,现象是___________ 。
(2)该盐酸的物质的量浓度为___________ 。
(3)同学计划用该浓盐酸配制 的稀盐酸,现实验需要稀盐酸
的稀盐酸,现实验需要稀盐酸 ,可供选用的仪器有:A.胶头滴管 B.烧瓶 C.烧杯 D.药匙 E.玻璃棒
,可供选用的仪器有:A.胶头滴管 B.烧瓶 C.烧杯 D.药匙 E.玻璃棒
①配制稀盐酸时,选择的仪器有:___________ (填序号),还缺少的仪器有___________ 。
②经计算,配制 的稀盐酸需要用量筒量取上述浓盐酸的体积为
的稀盐酸需要用量筒量取上述浓盐酸的体积为___________ mL。
③测定所配制的稀盐酸,发现其浓度大于 ,引起误差的原因可能是
,引起误差的原因可能是___________ 。
A.量取浓盐酸时俯视刻度线
B.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入容量瓶
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶刻度线
E.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
| 盐酸 分子式:  相对分子质量:36.5 密度约   的质量分数:36.5% 的质量分数:36.5% |
 的化学方程式
的化学方程式(2)该盐酸的物质的量浓度为
(3)同学计划用该浓盐酸配制
 的稀盐酸,现实验需要稀盐酸
的稀盐酸,现实验需要稀盐酸 ,可供选用的仪器有:A.胶头滴管 B.烧瓶 C.烧杯 D.药匙 E.玻璃棒
,可供选用的仪器有:A.胶头滴管 B.烧瓶 C.烧杯 D.药匙 E.玻璃棒①配制稀盐酸时,选择的仪器有:
②经计算,配制
 的稀盐酸需要用量筒量取上述浓盐酸的体积为
的稀盐酸需要用量筒量取上述浓盐酸的体积为③测定所配制的稀盐酸,发现其浓度大于
 ,引起误差的原因可能是
,引起误差的原因可能是A.量取浓盐酸时俯视刻度线
B.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入容量瓶
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶刻度线
E.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
您最近半年使用:0次
名校
5 . 室温下,某密闭容器中盛有 、
、 、
、 的混合气体,通过电火花点燃后,发生反应
的混合气体,通过电火花点燃后,发生反应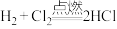 、
、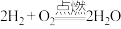 。容器内三种气体恰好完全反应,冷却至室温后得到质量分数为7.3%的盐酸,则容器中
。容器内三种气体恰好完全反应,冷却至室温后得到质量分数为7.3%的盐酸,则容器中 、
、 、
、 的体积比为
的体积比为___________ 。
 、
、 、
、 的混合气体,通过电火花点燃后,发生反应
的混合气体,通过电火花点燃后,发生反应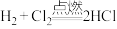 、
、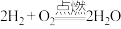 。容器内三种气体恰好完全反应,冷却至室温后得到质量分数为7.3%的盐酸,则容器中
。容器内三种气体恰好完全反应,冷却至室温后得到质量分数为7.3%的盐酸,则容器中 、
、 、
、 的体积比为
的体积比为
您最近半年使用:0次
名校
6 . 下列说法错误的是
| A.配制100g10%的NaCl溶液时,可能要用到托盘天平 |
| B.将100g20%的KOH溶液分成2等份,则每份溶液的质量分数均为20% |
| C.燃烧一定要有氧气参与反应 |
| D.有氧气参与且有电子得失的反应一定是氧化还原反应 |
您最近半年使用:0次
2023-11-15更新
|
37次组卷
|
2卷引用:河北省2023-2024学年高一上学期选科调考第二次联考化学试题
7 . 以 为原料制备
为原料制备 和
和 ,并利用
,并利用 冶炼金属钛(Ti)的工艺流程如下:
冶炼金属钛(Ti)的工艺流程如下:
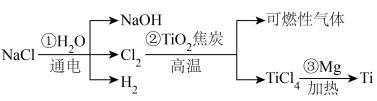
已知:高温条件下Ti的性质很活泼。
回答下列问题:
(1)在实际生产中,应避免步骤①的产物 与
与 接触发生副反应,降低
接触发生副反应,降低 纯度,解释其原因,用离子方程式表示为
纯度,解释其原因,用离子方程式表示为___________ 。
(2) 在
在 中燃烧的现象是
中燃烧的现象是___________ ,恰好完全反应后,将产物溶于水制得密度为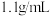 ,质量分数为
,质量分数为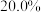 的盐酸溶液,其物质的量浓度为
的盐酸溶液,其物质的量浓度为___________ 。
(3)步骤②发生反应的化学方程式为___________ ,该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)步骤③须在稀有气体(如氩)的氛围下进行,稀有气体的作用是___________ 。
 为原料制备
为原料制备 和
和 ,并利用
,并利用 冶炼金属钛(Ti)的工艺流程如下:
冶炼金属钛(Ti)的工艺流程如下:
已知:高温条件下Ti的性质很活泼。
回答下列问题:
(1)在实际生产中,应避免步骤①的产物
 与
与 接触发生副反应,降低
接触发生副反应,降低 纯度,解释其原因,用离子方程式表示为
纯度,解释其原因,用离子方程式表示为(2)
 在
在 中燃烧的现象是
中燃烧的现象是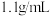 ,质量分数为
,质量分数为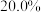 的盐酸溶液,其物质的量浓度为
的盐酸溶液,其物质的量浓度为(3)步骤②发生反应的化学方程式为
(4)步骤③须在稀有气体(如氩)的氛围下进行,稀有气体的作用是
您最近半年使用:0次
名校
解题方法
8 . 碘酸钙[Ca(IO3)2]是一种新型食品添加剂,实验室制取Ca(IO3)2的流程如图所示:

已知:HIO3易溶于水,不溶于有机溶剂;Ca(IO3)2不溶于乙醇,在水中的溶解度随温度降低而减小。
回答下列问题:
(1)实验室用MnO2固体和浓盐酸制取氯气的离子方程式为___________ 。
(2)“转化”步骤是为了获得碘酸,其装置如图(部分仪器已省略)。
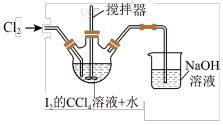
①“转化”反应在___________ (填仪器名称)中发生,其化学方程式为___________ 。
②判断“转化”反应完全的实验现象是___________ 。
(3)“分离”操作过程中所用的主要玻璃仪器是___________ ,验证所得水溶液中不含I2的方法是___________ 。
(4)加入CaCl2后保持在冰水浴中静置,抽滤,依次用冰水、乙醇洗涤,干燥。采用冰水浴的目的是___________ ;与过滤相比,抽滤的优点是___________ 。
(5)准确称取产品2.5000g,加酸溶解,转入250mL容量瓶内加水定容。移取25.00mL所配溶液,加入足量KI固体( +5I-+6H+=3I2+3H2O),暗处放置3min后,用0.2000mol·L-1Na2S2O3标准溶液滴定至溶液呈浅黄色(I2+2
+5I-+6H+=3I2+3H2O),暗处放置3min后,用0.2000mol·L-1Na2S2O3标准溶液滴定至溶液呈浅黄色(I2+2 =2I-+
=2I-+ ),滴入2~3滴淀粉溶液,继续滴定至终点,平行测定三次,平均消耗Na2S2O3标准溶液30.00mL。产品中Ca(IO3)2的质量分数为
),滴入2~3滴淀粉溶液,继续滴定至终点,平行测定三次,平均消耗Na2S2O3标准溶液30.00mL。产品中Ca(IO3)2的质量分数为___________ %。

已知:HIO3易溶于水,不溶于有机溶剂;Ca(IO3)2不溶于乙醇,在水中的溶解度随温度降低而减小。
回答下列问题:
(1)实验室用MnO2固体和浓盐酸制取氯气的离子方程式为
(2)“转化”步骤是为了获得碘酸,其装置如图(部分仪器已省略)。

①“转化”反应在
②判断“转化”反应完全的实验现象是
(3)“分离”操作过程中所用的主要玻璃仪器是
(4)加入CaCl2后保持在冰水浴中静置,抽滤,依次用冰水、乙醇洗涤,干燥。采用冰水浴的目的是
(5)准确称取产品2.5000g,加酸溶解,转入250mL容量瓶内加水定容。移取25.00mL所配溶液,加入足量KI固体(
 +5I-+6H+=3I2+3H2O),暗处放置3min后,用0.2000mol·L-1Na2S2O3标准溶液滴定至溶液呈浅黄色(I2+2
+5I-+6H+=3I2+3H2O),暗处放置3min后,用0.2000mol·L-1Na2S2O3标准溶液滴定至溶液呈浅黄色(I2+2 =2I-+
=2I-+ ),滴入2~3滴淀粉溶液,继续滴定至终点,平行测定三次,平均消耗Na2S2O3标准溶液30.00mL。产品中Ca(IO3)2的质量分数为
),滴入2~3滴淀粉溶液,继续滴定至终点,平行测定三次,平均消耗Na2S2O3标准溶液30.00mL。产品中Ca(IO3)2的质量分数为
您最近半年使用:0次
名校
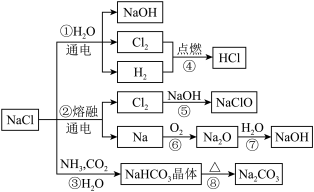
9 . NaCl用途广泛,是一种化工原料,可以制备多种物质,如图所示:
请回答下列问题:
(1)若工业上采用反应①制取NaOH,每生成1molNaOH转移的电子数目为____ 。
(2)反应④的实验现象为____ ;反应③的化学反应方程式为____ 。
(3)漂白粉的主要成分是Ca(ClO)2和CaCl2,有效成分为____ ,其久置失效的原理是____ 、___ (用化学反应方程式表示),故漂白粉须密封保存。
(4)某水产养殖场购买了某品牌的漂白粉,有效成分的质量分数约为25%。该养殖场工作人员从中取出200g漂白粉,溶解到1kg水中,用于池塘消毒,假设溶解后溶液密度为1g/cm3,则溶液中c[Ca(ClO)2]=____ mol/L(结果保留两位小数)。

请回答下列问题:
(1)若工业上采用反应①制取NaOH,每生成1molNaOH转移的电子数目为
(2)反应④的实验现象为
(3)漂白粉的主要成分是Ca(ClO)2和CaCl2,有效成分为
(4)某水产养殖场购买了某品牌的漂白粉,有效成分的质量分数约为25%。该养殖场工作人员从中取出200g漂白粉,溶解到1kg水中,用于池塘消毒,假设溶解后溶液密度为1g/cm3,则溶液中c[Ca(ClO)2]=
您最近半年使用:0次
22-23高一上·全国·课时练习
名校
10 . X、Y、Z、W、R五种元素的性质或结构信息如表,根据表中的信息回答下列问题:
(1)写出元素R在元素周期表中的位置:_______ 。
(2)由X、Z、R三种元素形成的化合物XRZ的分子式为_______ 。
(3)W与Z的单质在加热条件反应的化学方程式是_______ 。
(4)写出少量X的单质在盛满R的单质的集气瓶中燃烧的现象:_______ ,燃烧片刻后取出燃烧管,迅速将集气瓶倒扣在过量的烧碱溶液中,可能产生的现象是_______ ,所得溶液中存在的溶质除了过量的NaOH外,还含有的是_______ (填化学式)。
| 元素 | X | Y | Z | W | R |
| 性质或 结构信息 | 单质是最轻的气体 | 常见单质为空气中的主要成分之一 | 是海水中质量分数最大的元素 | 原子核内有11个质子 | 原子核外有3个电子层,常见单质为气体 |
(2)由X、Z、R三种元素形成的化合物XRZ的分子式为
(3)W与Z的单质在加热条件反应的化学方程式是
(4)写出少量X的单质在盛满R的单质的集气瓶中燃烧的现象:
您最近半年使用:0次



