名校
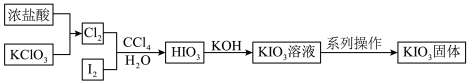
1 . 碘酸钾(KIO3)是重要的食品添加剂,某化学兴趣小组查阅资料得知,HIO3与KIO3均为白色固体,能溶于水,难溶于部分有机溶剂,且KIO3在碱性条件下易被ClO 氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
 氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
| A.浓盐酸在反应中体现了氧化性 |
| B.加入CCl4目的是萃取I2 |
| C.加入KOH前,应先对原溶液加热煮沸 |
| D.系列操作包括:加入乙醇溶液、搅拌、静置、过滤、洗涤、干燥 |
您最近半年使用:0次
2020-11-26更新
|
616次组卷
|
2卷引用:江苏省启东市2021届高三上学期期中考试化学试题
2022高三·全国·专题练习
2 . 在Cl2与金属、非金属的反应中,下列说法正确的是
| A.与金属反应时一定表现氧化性 | B.与非金属反应时表现还原性 |
| C.与金属反应时表现酸性 | D.在与非金属的化合物中均表现负价 |
您最近半年使用:0次
3 . 下列关于氯元素的说法正确的是( )
| A.HCl 具有很强的酸性,且只有氧化性没有还原性 |
| B.3517Cl、 3717Cl为不同的核素,有完全不同的化学性质 |
| C.1.12L Cl2含有 1 .7NA个质子(NA表示阿伏伽德罗常数) |
| D.氯气可从 KI 溶液中置换出 I2,说明氯的非金属性比碘强 |
您最近半年使用:0次
名校
4 . 自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示。完成下列问题:
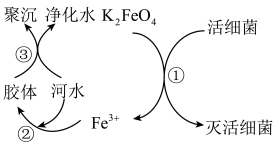
(1)K2FeO4的电离方程式______ 。过程①中K2FeO4表现了______ (填“氧化”或“还原”)性。
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有______ 、______ (填两个)。
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO______ K2FeO4。
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用单线桥法 表示电子转移的方向和数目说明______ ;
世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:
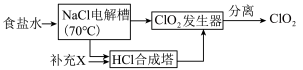
(4)该工艺中,需要补充的物质X为______ (填化学式,下同)。
(5)能参与循环的物质是______ 。
已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:
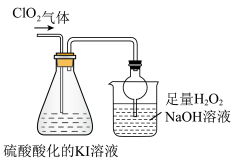
(6)锥形瓶内ClO2进气导管不伸入液面以下,原因是______ 。
(7)烧杯内液体用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2:1,则还原产物的化学式是______ 。
反应后向锥形瓶中加入少量四氯化碳,溶液上下分层,下层为紫红色
已知:I2+Na2S=2NaI+S
(8)若将锥形瓶内溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:______ 。
②请设计实验证明你的假设(仅用离子方程式表示):______ 。

(1)K2FeO4的电离方程式
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用
世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O
 NaClO3+3H2↑
NaClO3+3H2↑发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:

(4)该工艺中,需要补充的物质X为
(5)能参与循环的物质是
已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:

(6)锥形瓶内ClO2进气导管不伸入液面以下,原因是
(7)烧杯内液体用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2:1,则还原产物的化学式是
反应后向锥形瓶中加入少量四氯化碳,溶液上下分层,下层为紫红色
已知:I2+Na2S=2NaI+S
(8)若将锥形瓶内溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:
②请设计实验证明你的假设(仅用离子方程式表示):
您最近半年使用:0次
2023-03-04更新
|
300次组卷
|
2卷引用:上海市杨浦高级中学2022-2023学年高一上学期期末考试化学试题
解题方法
5 . 某小组设计实验比较 、
、 的氧化性强弱,下列装置中不需要的是
的氧化性强弱,下列装置中不需要的是
 、
、 的氧化性强弱,下列装置中不需要的是
的氧化性强弱,下列装置中不需要的是A. | B.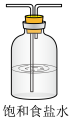 | C. | D. |
您最近半年使用:0次
2024-01-03更新
|
142次组卷
|
2卷引用:山西省忻州市名校2023-2024学年高三上学期联合质量检测化学试卷
18-19高一·浙江·期末
6 . 下列说法正确的是
| A.氯气能将单质铁还原为氯化铁 |
| B.盐酸既有氧化性又有还原性 |
| C.氢气在氯气中剧烈燃烧,火焰呈苍白色,有白烟生成 |
| D.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
您最近半年使用:0次
名校
7 . 请用下列装置设计一个实验,证明Cl2的氧化性比I2的氧化性强。
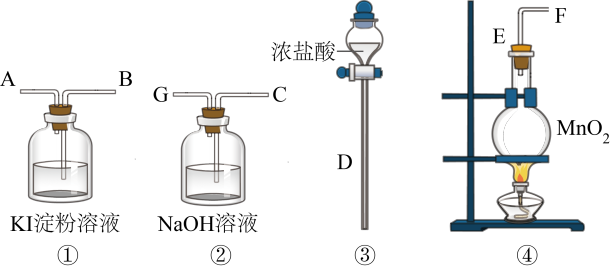
请回答下列问题:
(1)圆底烧瓶中发生反应的化学方程式为___________ 。
(2)证明Cl2比I2的氧化性强的实验现象是___________ ,反应的离子方程式是___________ 。
(3)装置②的作用是___________ 。
(4)若要证明Cl2的氧化性比Br2强,则需做的改动是___________ 。

请回答下列问题:
(1)圆底烧瓶中发生反应的化学方程式为
(2)证明Cl2比I2的氧化性强的实验现象是
(3)装置②的作用是
(4)若要证明Cl2的氧化性比Br2强,则需做的改动是
您最近半年使用:0次
名校
解题方法
8 . 如图是一套制取并验证氯气部分化学性质的实验装置。已知:I2遇淀粉变蓝色。
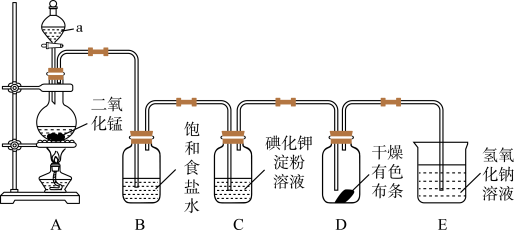
(1)装置A中,仪器a的名称___________ ,该仪器中盛放的试剂为___________ ,写出A装置发生反应的离子方程式:___________ 实验室用固体KClO3与浓HCl反应也可以制Cl2,反应的化学方程式为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,若该反应生成6.72L(标准状况)Cl2,转移的电子数为___________ mol。
(2)B装置中饱和食盐水的作用是___________ ;当有少量Cl2通过后,观察到装置C中溶液变成蓝色,反应的离子方程式为:___________ 说明氧化性Cl___________ I(填“>”或“<”)。
(3)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?___________ 。
(4)若要证明Cl2无漂白性,则必须在装置___________ (用装置字母序号填写)之前增加一个___________ 的装置。
(5)装置E的作用是尾气处理,该反应的离子方程式为___________ 。
(6)家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:___________ 。
(7)Cl2可用于自来水消毒,但Cl2会与水中的有机物发生反应,生成对人体有害的有机氯化物,因此,从2000年开始,国家开始逐渐用ClO2取代Cl2对自来水消毒。ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室可利用KClO3与H2C2O4(已知H2C2O4为弱酸)在酸性条件下反应,制取ClO2.请写出该反应的离子方程式:___________ 。该反应中还原产物的化学式是___________ ,被氧化的元素是___________ (填元素符号)。

(1)装置A中,仪器a的名称
(2)B装置中饱和食盐水的作用是
(3)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?
(4)若要证明Cl2无漂白性,则必须在装置
(5)装置E的作用是尾气处理,该反应的离子方程式为
(6)家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:
(7)Cl2可用于自来水消毒,但Cl2会与水中的有机物发生反应,生成对人体有害的有机氯化物,因此,从2000年开始,国家开始逐渐用ClO2取代Cl2对自来水消毒。ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室可利用KClO3与H2C2O4(已知H2C2O4为弱酸)在酸性条件下反应,制取ClO2.请写出该反应的离子方程式:
您最近半年使用:0次
名校
9 . 向KI溶液中加入氯水,发生 。下列说法
。下列说法不正确 的是
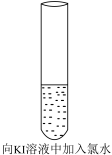
 。下列说法
。下列说法
| A.氯水具有氧化性、酸性、漂白性等多重性质 |
| B.停止反应后,取少量溶液滴加淀粉溶液,溶液变蓝 |
C.溶液颜色变化说明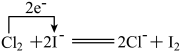 |
| D.实验结果说明,氯气的氧化性强于碘的氧化性 |
您最近半年使用:0次
名校
10 . 部分含氯物质价一类二维图如下:
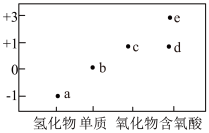
下列叙述错误的是

下列叙述错误的是
| A.c、e的化学式分别为Cl2O、HClO2 | B.d具有强氧化性、漂白性、酸性和不稳定性 |
| C.c与水发生化合反应生成d | D.不能一步实现a→b→d→a循环转化 |
您最近半年使用:0次
2023-02-08更新
|
209次组卷
|
2卷引用:广东省惠州市第一中学2022-2023学年高一上学期期末考试化学试题



