名校
解题方法
1 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
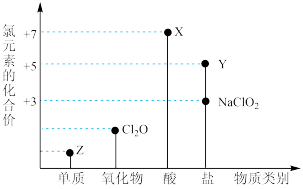
回答下列问题:
(1)X的电离方程式为_________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=_________ 。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___________ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________ 。
(6)自来水中的 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___ Al+ ____  +
+ _____ =___ 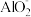 +
+ _____ N2↑ + _______ H2O

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
(6)自来水中的
 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平: +
+ 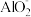 +
+
您最近一年使用:0次
2020-06-15更新
|
101次组卷
|
2卷引用:江西省南昌市八一中学2019-2020学年高一下学期期中考试化学试题
名校
2 . 下列有关物质性质、用途的描述错误的是
A. 易液化,可用于制取漂白液 易液化,可用于制取漂白液 |
B. 有还原性,在葡萄酒中添加适量的 有还原性,在葡萄酒中添加适量的 能防止葡萄酒的氧化变质 能防止葡萄酒的氧化变质 |
C.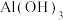 分解生成 分解生成 和 和 是吸热反应,故 是吸热反应,故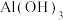 可用作阻燃剂 可用作阻燃剂 |
D.铁粉具有还原性,能够除去污水中的 、 、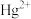 |
您最近一年使用:0次
2024-04-17更新
|
673次组卷
|
5卷引用:江西省部分地区2023-2024学年高三下学期3月月考化学试题
江西省部分地区2023-2024学年高三下学期3月月考化学试题广西壮族自治区部分学校2023-2024学年高三下学期教学质量监测联考(二模)化学试题甘肃省酒泉市九师联盟2023-2024学年高三下学期3月月考化学试题(已下线)题型6 元素及其化合物 化学实验基础(25题)-2024年高考化学常考点必杀300题(新高考通用)湖北省九师联盟2024届高三下学期3月质量检测(W-G)化学试卷
名校
3 . 氯气在工业生产中有重要的用途。某课外活动小组利用下列化学反应在实验室中制备氯气,并进行有关氯气性质的研究。
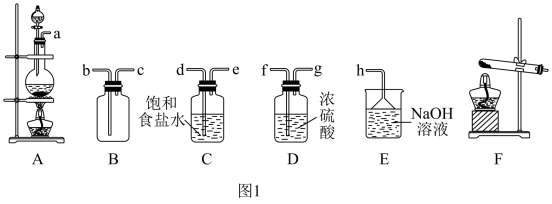
(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学反应方程式:___________ ;浓盐酸起酸性作用和还原剂作用的质量之比为___________ 。
②选择装置,将各仪器按先后顺序连接起来,应该是a接___________,___________接___________,___________接___________,___________接h。(用导管口处的字母表示)___________
(2)E装置吸收氯气,可得漂白液的有效成分:___________ (填化学式);若将氯气通入冷的石灰乳中,可得漂白粉,写出反应方程式:___________ 。
(3)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。
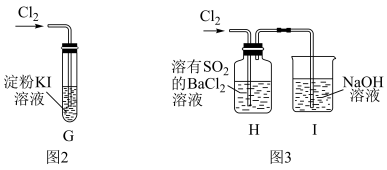
①G中的现象是___________ ,原因是___________ (用化学方程式表示)。
②H中的现象是___________ 。

(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学反应方程式:
②选择装置,将各仪器按先后顺序连接起来,应该是a接___________,___________接___________,___________接___________,___________接h。(用导管口处的字母表示)
(2)E装置吸收氯气,可得漂白液的有效成分:
(3)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。

①G中的现象是
②H中的现象是
您最近一年使用:0次
2021-12-26更新
|
869次组卷
|
3卷引用:江西省抚州市乐安县第二中学2023-2024学年高一上学期11月期中化学试题
4 . 高铁酸盐在能源、环保等方面有着广泛的用途,在生产和生活中有广泛的应用。
已知:i.高铁酸钠(Na2FeO4)极易溶解于水,20℃溶解度为111克;高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。
ii.高铁酸钾(K2FeO4)在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
iii.高铁酸根在水溶液中存在平衡: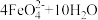 ⇌
⇌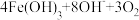 ↑
↑
(1)工业上用氯气和烧碱溶液可以制取次氯酸钠,反应的离子方程式为___________ 。
(2)高铁酸钾是一种理想的水处理剂,既可以对水杀菌消毒,又可以净化水,其原理为________ 。
(3)工业上有多种方法制备高铁酸钾。
方法1:次氯酸盐氧化法。工艺流程如图所示。
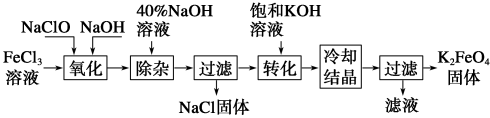
①“氧化”过程中的氧化剂为(填化学式)______________ 。
②写出“转化”过程中的化学方程式为__________________ 。
③上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品先用稀KOH溶液溶解,然后再加入饱和KOH溶液,冷却结晶过滤。上述操作中溶解粗产品用稀KOH溶液,不用蒸馏水,根据平衡移动原理解释__________ 。
(4)方法2:电解法
我国化学工作者还提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如下图所示。
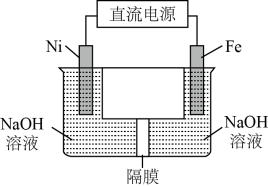
①Ni电极作________ (填“阴”或“阳”)极;
②Fe电极的电极反应式:____________ 。
已知:i.高铁酸钠(Na2FeO4)极易溶解于水,20℃溶解度为111克;高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。
ii.高铁酸钾(K2FeO4)在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
iii.高铁酸根在水溶液中存在平衡:
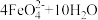 ⇌
⇌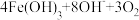 ↑
↑(1)工业上用氯气和烧碱溶液可以制取次氯酸钠,反应的离子方程式为
(2)高铁酸钾是一种理想的水处理剂,既可以对水杀菌消毒,又可以净化水,其原理为
(3)工业上有多种方法制备高铁酸钾。
方法1:次氯酸盐氧化法。工艺流程如图所示。

①“氧化”过程中的氧化剂为(填化学式)
②写出“转化”过程中的化学方程式为
③上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品先用稀KOH溶液溶解,然后再加入饱和KOH溶液,冷却结晶过滤。上述操作中溶解粗产品用稀KOH溶液,不用蒸馏水,根据平衡移动原理解释
(4)方法2:电解法
我国化学工作者还提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如下图所示。

①Ni电极作
②Fe电极的电极反应式:
您最近一年使用:0次
2020-07-05更新
|
156次组卷
|
2卷引用:江西省宜春市2020-2021学年高二年级上学期期末质量监测化学试题



