1 . 下列有关物质性质与用途具有对应关系的是( )
| A.Al具有良好的导电性,可用于制铝箔 | B.Fe2O3粉末呈红色,可用于制颜料、油漆 |
| C.NaClO溶液显碱性,可用于杀菌消毒 | D.HNO3有酸性,可用于洗涤附有银镜的试管 |
您最近半年使用:0次
名校
2 . 下列有关物质性质与用途都正确且具有对应关系的是( )
| A.ClO2具有强氧化性,可用于水消毒剂 |
| B.石英熔点高,可用于制造石英研钵 |
| C.氢氧化铝受热易分解,可用作胃酸中和剂 |
| D.生石灰能与水反应,可用于干燥氯气 |
您最近半年使用:0次
2019-12-31更新
|
325次组卷
|
2卷引用:华南师范大学附中2020届高三上学期第三次月考理综化学试题
3 . 下列有关物质性质与用途具有对应关系的是
| A.二氧化硫具有氧化性,可用于漂白纸浆 |
| B.葡萄糖具有还原性,可用于化学镀银 |
| C.氢氟酸呈酸性,可用于在玻璃器皿上刻蚀标记 |
| D.生石灰能与水反应,可用来干燥氯气 |
您最近半年使用:0次
解题方法
4 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。
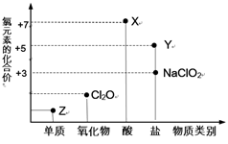
回答下列问题:
(1)X的电离方程式为______ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=______ 。
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学键类型为______ 。
(4)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为______ 。

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3)Y可用于实验室制O2,其焰色试验为紫色,则Y含有的化学键类型为
(4)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
您最近半年使用:0次
名校
解题方法
5 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
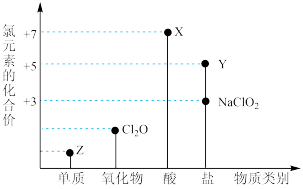
回答下列问题:
(1)X的电离方程式为_________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=_________ 。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___________ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________ 。
(6)自来水中的 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___ Al+ ____  +
+ _____ =___  +
+ _____ N2↑ + _______ H2O

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
(6)自来水中的
 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平: +
+  +
+
您最近半年使用:0次
2020-06-15更新
|
101次组卷
|
2卷引用:江西省南昌市八一中学2019-2020学年高一下学期期中考试化学试题
名校
6 . 下列物质性质与应用对应关系不正确的是( )
| A.生石灰能与水反应,可用于实验室干燥氯气 |
| B.二氧化氯具有强氧化性,可用于自来水的杀菌消毒 |
| C.常温下,铝与浓硫酸发生钝化,可用铝槽车贮运浓硫酸 |
| D.钠是一种具有强还原性的金属,可用于冶炼钛、锆、铌等金属 |
您最近半年使用:0次
2020-04-18更新
|
124次组卷
|
2卷引用:江苏省苏州新草桥中学2020届高三上学期10月月考化学试题
7 . 某漂粉精说明书如下:
(1)从主要成分看,可知生产漂粉精的原料是氯气和石灰乳,请写出制漂粉精的化学方程式:_______ ,漂粉精中有效成分为_______ 。
(2)生活中常有的漂白剂还有“84消毒液”,制备“84消毒液”的反应物是通过氯碱工业制得,请写出电解饱和食盐水的化学方程式:_______ ,并进一步写出制备“84消毒液”的化学方程式_______ 。
(3)为什么家庭中的漂白剂使用漂粉精,而不使用氯水?_______ 。
| 使用说明书 主要成分:次氯酸钙、氯化钙 用途用量:取漂粉精2-3克,水100克,配成溶液,将禽流感病人用具浸泡其中5-10分钟,如需要可延长时间,提高浓度。 注意事项:密封保存于阴凉处,随配随用,有腐蚀性,少与手接触。 |
(2)生活中常有的漂白剂还有“84消毒液”,制备“84消毒液”的反应物是通过氯碱工业制得,请写出电解饱和食盐水的化学方程式:
(3)为什么家庭中的漂白剂使用漂粉精,而不使用氯水?
您最近半年使用:0次
名校
8 . 下列关于物质用途的说法中,不正确 的是( )
| A.熟石灰可用作干燥剂 | B.氯气可用于制备漂白粉 |
| C.Na2O2可用于呼吸面具供给氧气 | D.钠可用于制造高压钠灯 |
您最近半年使用:0次
名校
解题方法
9 . 氯气有广泛的用途,回答下列问题:
(1)氯气可以用于制备“战略金属”钛,其中有关反应如下,用双线桥(或单线桥)标出反应中电子转移的方向和数目:TiO2+2C+2Cl2 TiCl4+2CO。
TiCl4+2CO。___
(2)反应8NH3+3Cl2=N2+6NH4Cl可用于氯气管道的检漏,在该反应中,N2为__ 产物(填“氧化”或“还原”)
(3)氯气可与NaOH溶液反应制备“84”消毒液,在2020年初抗击新冠病毒感染的肺炎(Covid-19)疫情中,“84”消毒液发挥了重要的作用。但若将“84”消毒液与洗厕剂洁厕灵混合使用,则会产生氯气,其反应的离子方程式是:__ 。
(4)氯气可与水反应,产生有漂白、杀菌作用的物质,反应的离子方程式为__ ;氯气可以用于制备漂白粉,漂白粉的有效成分是__ (填化学式)。
(5)实验室检验某溶液中是否含有Cl-的操作方法是:__ 。
(1)氯气可以用于制备“战略金属”钛,其中有关反应如下,用双线桥(或单线桥)标出反应中电子转移的方向和数目:TiO2+2C+2Cl2
 TiCl4+2CO。
TiCl4+2CO。(2)反应8NH3+3Cl2=N2+6NH4Cl可用于氯气管道的检漏,在该反应中,N2为
(3)氯气可与NaOH溶液反应制备“84”消毒液,在2020年初抗击新冠病毒感染的肺炎(Covid-19)疫情中,“84”消毒液发挥了重要的作用。但若将“84”消毒液与洗厕剂洁厕灵混合使用,则会产生氯气,其反应的离子方程式是:
(4)氯气可与水反应,产生有漂白、杀菌作用的物质,反应的离子方程式为
(5)实验室检验某溶液中是否含有Cl-的操作方法是:
您最近半年使用:0次
2020-11-20更新
|
140次组卷
|
2卷引用:广东省汕头市澄海中学2020-2021学年高一上学期期中考试化学试题
名校
10 . Cl2是一种重整的化工原料,在生产、生活和工业上均有很多用途。
(1)可与氢气化合制得盐酸。化学方程式为________________ 。
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为_______________ 。
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为_______________ 。其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是_____________ 。
②Ⅰ中,生成K2MnO4的化学方程式是____________ 。
③Ⅱ中,浸取时用稀KOH溶液的原因是_____________ 。
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为____________ 。
(1)可与氢气化合制得盐酸。化学方程式为
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是
②Ⅰ中,生成K2MnO4的化学方程式是
③Ⅱ中,浸取时用稀KOH溶液的原因是
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO
 +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为
您最近半年使用:0次



