1 . Ⅰ.氨的制备
氨在化工生产领域有广泛应用,历史上曾有三位科学家在合成氨领域获得诺贝尔化学奖。

(1)实验室常用铵盐与强碱反应制取氨气,可选择装置___________ (填“A”或“B”),反应的化学方程式为___________ 。
(2)制备干燥的 时,发生、净化、收集和尾气处理装置的接口顺序为
时,发生、净化、收集和尾气处理装置的接口顺序为___________ (按气流方向填写小写字母)
(3)检验某溶液中存在 的操作及现象为
的操作及现象为___________ 。
(4)工业上在一定温度和催化剂条件下,可用 消除
消除 污染,生成两种对环境无害的物质,请写出
污染,生成两种对环境无害的物质,请写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
Ⅱ.某实验小组研究 与溶液的反应,实验如下:
与溶液的反应,实验如下:
实验中所取镁粉质量均为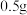 ,分别加入到选取的实验试剂中。
,分别加入到选取的实验试剂中。
资料:a. 溶液呈中性;b.Cl-对该反应几乎无影响。
溶液呈中性;b.Cl-对该反应几乎无影响。
(5)甲同学认为实验2比实验1反应剧烈的原因是 溶液中
溶液中 大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
试剂X是___________ 。
(6)为进一步探究实验2反应剧烈的原因,进行实验4:
依据上述实验,可以得出Mg能与 反应生成
反应生成 ,乙同学认为该方案不严谨,需要补充的实验方案是
,乙同学认为该方案不严谨,需要补充的实验方案是___________ 。
实验总结:通过上述实验,该小组同学得出Mg能与 反应生成
反应生成 的结论。
的结论。
氨在化工生产领域有广泛应用,历史上曾有三位科学家在合成氨领域获得诺贝尔化学奖。

(1)实验室常用铵盐与强碱反应制取氨气,可选择装置
(2)制备干燥的
 时,发生、净化、收集和尾气处理装置的接口顺序为
时,发生、净化、收集和尾气处理装置的接口顺序为(3)检验某溶液中存在
 的操作及现象为
的操作及现象为(4)工业上在一定温度和催化剂条件下,可用
 消除
消除 污染,生成两种对环境无害的物质,请写出
污染,生成两种对环境无害的物质,请写出 与
与 反应的化学方程式
反应的化学方程式Ⅱ.某实验小组研究
 与溶液的反应,实验如下:
与溶液的反应,实验如下:实验中所取镁粉质量均为
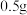 ,分别加入到选取的实验试剂中。
,分别加入到选取的实验试剂中。资料:a.
 溶液呈中性;b.Cl-对该反应几乎无影响。
溶液呈中性;b.Cl-对该反应几乎无影响。| 实验 | 实验试剂 | 实验现象 |
| 1 |  蒸馏水 蒸馏水 | 反应缓慢,有少量气泡产生(经检验为H2) |
| 2 | 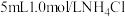 溶液 溶液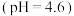 | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
 溶液中
溶液中 大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。| 实验 | 实验装置 | 现象 |
| 3 | 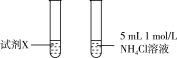 | 两试管反应剧烈程度相当 |
(6)为进一步探究实验2反应剧烈的原因,进行实验4:
| 实验 | 实验试剂 | 实验现象 |
| 4 | 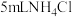 乙醇溶液 乙醇溶液 | 有无色无味气体产生(经检验为 ) ) |
 反应生成
反应生成 ,乙同学认为该方案不严谨,需要补充的实验方案是
,乙同学认为该方案不严谨,需要补充的实验方案是实验总结:通过上述实验,该小组同学得出Mg能与
 反应生成
反应生成 的结论。
的结论。
您最近半年使用:0次
名校
2 . 硫和氮及其化合物性质具有多样性。
(1)与氮氧化物有关的全球性大气环境问题有___________(填序号)。
(2)氨基钠(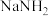 )可以用于生产安全气囊气体发生剂
)可以用于生产安全气囊气体发生剂 ,实验小组用下图装置来制备少量的氨基钠。已知:
,实验小组用下图装置来制备少量的氨基钠。已知: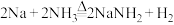 ,氨基钠极易与水剧烈反应,且易被空气氧化。
,氨基钠极易与水剧烈反应,且易被空气氧化。
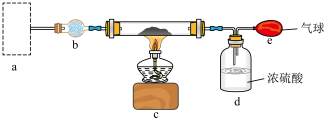
①a为氨气的发生装置,选择下列___________ 装置(填装置的标号)和___________ (填试剂标号)来制备氨气。
可选装置:
可选试剂:A.氯化铵固体 B.浓氨水和生石灰
②下列关于制备氨基钠实验的说法中正确的是___________ (填选项字母)。
A.b装置中所装药品是无水氯化钙
B.d中长导管不伸入液面是为了防止倒吸
C.实验开始时,为使氨气充分反,应先点燃c处酒精灯,再通入氨气
D.该实验方案存在缺陷,应在e、d之间再增加一个b装置,或用装有无水氯化钙的干燥管替换d装置
(3)选用下面的装置探究酸性: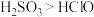
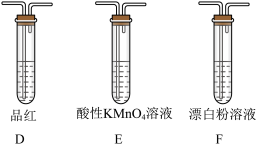
①装置连接顺序为A→___________ →F(4个装置都要使用);
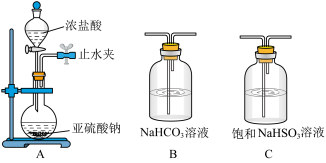
②能证明 的酸性强于HClO的实验现象为:
的酸性强于HClO的实验现象为:___________ ;
③写出装置E中发生反应的离子方程式___________ 。
(1)与氮氧化物有关的全球性大气环境问题有___________(填序号)。
| A.酸雨 | B.沙尘暴 | C.光化学烟雾 | D.白色污染 |
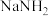 )可以用于生产安全气囊气体发生剂
)可以用于生产安全气囊气体发生剂 ,实验小组用下图装置来制备少量的氨基钠。已知:
,实验小组用下图装置来制备少量的氨基钠。已知: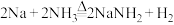 ,氨基钠极易与水剧烈反应,且易被空气氧化。
,氨基钠极易与水剧烈反应,且易被空气氧化。
①a为氨气的发生装置,选择下列
可选装置:

可选试剂:A.氯化铵固体 B.浓氨水和生石灰
②下列关于制备氨基钠实验的说法中正确的是
A.b装置中所装药品是无水氯化钙
B.d中长导管不伸入液面是为了防止倒吸
C.实验开始时,为使氨气充分反,应先点燃c处酒精灯,再通入氨气
D.该实验方案存在缺陷,应在e、d之间再增加一个b装置,或用装有无水氯化钙的干燥管替换d装置
(3)选用下面的装置探究酸性:
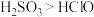


①装置连接顺序为A→
②能证明
 的酸性强于HClO的实验现象为:
的酸性强于HClO的实验现象为:③写出装置E中发生反应的离子方程式
您最近半年使用:0次
名校
3 . 利用如图装置进行 的制备及性质探究实验。下列说法不正确的是
的制备及性质探究实验。下列说法不正确的是
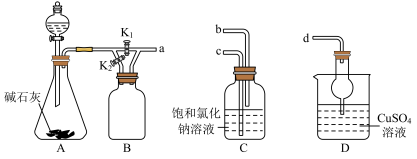
 的制备及性质探究实验。下列说法不正确的是
的制备及性质探究实验。下列说法不正确的是
A.使用A装置制备 时,分液漏斗中盛放浓氨水 时,分液漏斗中盛放浓氨水 |
B.装置B中盛放湿润红色石蕊试纸,打开 ,关闭 ,关闭 ,可证明 ,可证明 为碱性气体 为碱性气体 |
| C.利用C装置模拟候氏制碱法时,可将a和c连接 |
D.将a和d连接验证 与 与 的配位能力强于 的配位能力强于 |
您最近半年使用:0次
2023-06-05更新
|
45次组卷
|
2卷引用:湘桂黔名校2022-2023学年高二下学期5月联考化学试题
4 . 某课外活动小组验证氨的某些性质并收集少量纯净的N2.实验进行一段时间后,观察到黑色CuO变红,无水CuSO4变蓝,并且在最后的导管末端处收集到纯净、干燥的N2。下列说法不正确的是
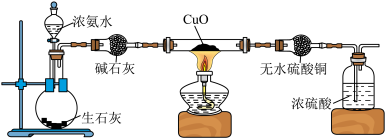

| A.盛放浓氨水的仪器是分液漏斗 |
| B.该实验证明氨气具有还原性 |
| C.最后出气管口可以用塑料袋或球胆收集氮气 |
| D.洗气瓶中浓硫酸的作用只有吸收多余氨气 |
您最近半年使用:0次
解题方法
5 . 下列有关含氮化合物的说法正确的是
| A.液氨制冷和NH4Cl气化都不涉及化学变化 |
| B.将湿润的红色石蕊试纸伸入集气瓶内,试纸变蓝则证明NH3已收集满 |
| C.氮氧化物进入大气后,会形成硝酸型酸雨,还可能形成光化学烟雾 |
| D.某浓硝酸中含有2mol硝酸,该浓硝酸与足量的铜完全反应可生成1molNO2 |
您最近半年使用:0次
2022-06-15更新
|
152次组卷
|
2卷引用:河北省邯郸市九校联考2021-2022学年高一下学期期中考试化学试题
21-22高一·全国·假期作业
解题方法
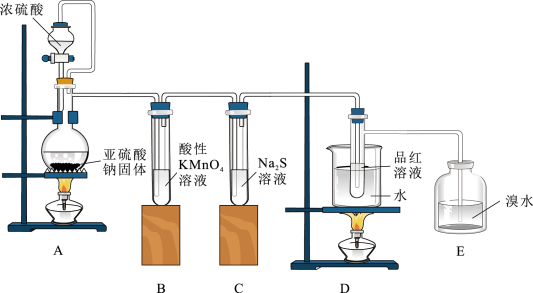
6 .  在生产生活中有重要的用途。某化学小组尝试制备
在生产生活中有重要的用途。某化学小组尝试制备 并探究
并探究 的某些性质,进行了以下实验:
的某些性质,进行了以下实验:
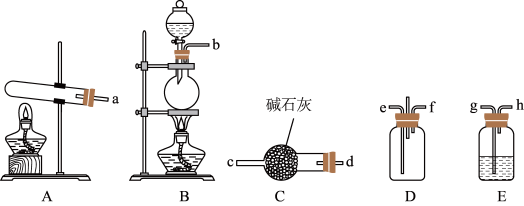
(1)该小组用 和HCl合成
和HCl合成 。
。
①写出用A装置制备 的化学方程式
的化学方程式_______ 。
②用B装置制备HCl,E装置中的试剂为_______ ;为使 和HCl在D中充分混合并反应,上述装置的连接顺为a→d→c→
和HCl在D中充分混合并反应,上述装置的连接顺为a→d→c→_______ 、_______ ←h←g←b。
③装置D处除易堵塞导管外,还有不足之处为_______ 。
(2)该小组为探究Mg与 溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。
溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。
资料:a.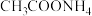 溶液呈中性;
溶液呈中性;
b. 对该反应几乎无影响。
对该反应几乎无影响。
①经检验实验2中刺激性气味气体为 ,检验方法是
,检验方法是_______ 用排水法收集一小试管产生的气体,经检验小试管中气体为 。
。
②已知灰白色沉淀中含有 、
、 。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加
。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加 溶液后无明显浑浊。将洗涤后固体溶于稀
溶液后无明显浑浊。将洗涤后固体溶于稀 ,再滴加
,再滴加 溶液,出现白色沉淀。灰白色固体可能是
溶液,出现白色沉淀。灰白色固体可能是_______ (填化学式)。
③甲同学认为实验2比实验1反应剧烈的原因是 溶液中
溶液中 大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
试剂X是_______ 。
④为进一步探究实验2反应剧烈的原因,进行实验4。
依据上述实验,可以得出Mg能与 反应生成
反应生成 。乙同学认为该方案不严谨,需要补充的实验方案是
。乙同学认为该方案不严谨,需要补充的实验方案是_______ 。
⑤实验总结:通过上述实验,该小组同学得出Mg能与 反应生成
反应生成 的结论。
的结论。
 在生产生活中有重要的用途。某化学小组尝试制备
在生产生活中有重要的用途。某化学小组尝试制备 并探究
并探究 的某些性质,进行了以下实验:
的某些性质,进行了以下实验:
(1)该小组用
 和HCl合成
和HCl合成 。
。①写出用A装置制备
 的化学方程式
的化学方程式②用B装置制备HCl,E装置中的试剂为
 和HCl在D中充分混合并反应,上述装置的连接顺为a→d→c→
和HCl在D中充分混合并反应,上述装置的连接顺为a→d→c→③装置D处除易堵塞导管外,还有不足之处为
(2)该小组为探究Mg与
 溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。
溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。资料:a.
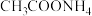 溶液呈中性;
溶液呈中性;b.
 对该反应几乎无影响。
对该反应几乎无影响。| 实验 | 实验试剂 | 实验现象 |
| 1 | 5mL蒸馏水 | 反应缓慢,有少量气泡产生(经检验为 ) ) |
| 2 | 5mL 1.0mol/L  溶液(pH=4.6) 溶液(pH=4.6) | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
 ,检验方法是
,检验方法是 。
。②已知灰白色沉淀中含有
 、
、 。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加
。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加 溶液后无明显浑浊。将洗涤后固体溶于稀
溶液后无明显浑浊。将洗涤后固体溶于稀 ,再滴加
,再滴加 溶液,出现白色沉淀。灰白色固体可能是
溶液,出现白色沉淀。灰白色固体可能是③甲同学认为实验2比实验1反应剧烈的原因是
 溶液中
溶液中 大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。| 实验 | 实验装置 | 现象 |
| 3 |  | 两试管反应剧烈程度相当 |
④为进一步探究实验2反应剧烈的原因,进行实验4。
| 实验 | 实验试剂 | 实验现象 |
| 4 | 5mL  乙醇溶液 乙醇溶液 | 有无色无味气体产生(经检验为 ) ) |
 反应生成
反应生成 。乙同学认为该方案不严谨,需要补充的实验方案是
。乙同学认为该方案不严谨,需要补充的实验方案是⑤实验总结:通过上述实验,该小组同学得出Mg能与
 反应生成
反应生成 的结论。
的结论。
您最近半年使用:0次
名校
7 . Ⅰ.将50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:
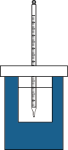
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______ 。
(2)中和热测定实验中,下列说法不正确的是_______。
(3)他们记录的实验数据如下:
(已知: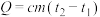 ,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为
,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为 )
)
①根据实验结果计算出NaOH溶液与HCl溶液反应的中和热
_______  。
。
②若实验过程中,内筒未加杯盖,求得的中和反应反应热数值_______ (填“偏大”“偏小”或“无影响”)。
③若用醋酸代替HCl做实验,对测定结果_______ (填“偏大”“偏小”或“无影响”)。
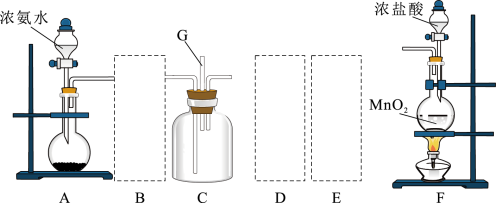
Ⅱ.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
请回答下列问题:
(4)装置A中的烧瓶内固体不可选用_______(填字母)。
(5)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B、D、E从左至右依次选择的装置顺序为_______ 。
(6)氯气和氨气在常温下混合就能发生反应,现象为产生白烟,则C中反应的化学方程式为_______ 。
(7)某研究小组设计了一套制备及检验 部分性质的装置:
部分性质的装置:
实验过程中观察到装置B中的现象是_______ ,反应的离子方程式为_______ ,C装置证明 具有
具有_______ 性。
(8)E中的化学反应方程式为_______ 。
(9)D装置的作用是_______ 。

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)中和热测定实验中,下列说法不正确的是_______。
| A.改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,求出的中和热数值和原来不同 |
| B.酸碱混合时,量筒中NaOH溶液应分三次倒入小烧杯中 |
| C.所加NaOH溶液过量,目的是保证盐酸完全被中和 |
| D.装置中隔热层的作用是保温隔热、减少热量损失 |
| 实验用品 | 溶液温度 | 中和热 | |||
 |  |  | |||
| ① | 50mL  NaOH溶液 NaOH溶液 | 50mL  HCl 溶液 HCl 溶液 | 20℃ | 23.3℃ | |
| ② | 50mL  NaOH溶液 NaOH溶液 | 50mL  HCl 溶液 HCl 溶液 | 20℃ | 23.5℃ | |
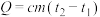 ,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为
,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为 )
)①根据实验结果计算出NaOH溶液与HCl溶液反应的中和热

 。
。②若实验过程中,内筒未加杯盖,求得的中和反应反应热数值
③若用醋酸代替HCl做实验,对测定结果
Ⅱ.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。

请回答下列问题:
(4)装置A中的烧瓶内固体不可选用_______(填字母)。
| A.碱石灰 | B.烧碱 | C.生石灰 | D.五氧化二磷 |
| 备选装置 | ||
 |  | 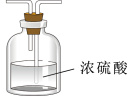 |
| Ⅰ | Ⅱ | Ⅲ |
(6)氯气和氨气在常温下混合就能发生反应,现象为产生白烟,则C中反应的化学方程式为
(7)某研究小组设计了一套制备及检验
 部分性质的装置:
部分性质的装置:
实验过程中观察到装置B中的现象是
 具有
具有(8)E中的化学反应方程式为
(9)D装置的作用是
您最近半年使用:0次
2022-05-18更新
|
514次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高一下学期期中考试(选考)化学试题
名校
8 . NH4Cl在生产生活中有重要的用途。某化学小组尝试制备NH4Cl并探究NH4Cl的某些性质,进行了以下实验:
(1)该小组用NH3和HCl合成NH4Cl。
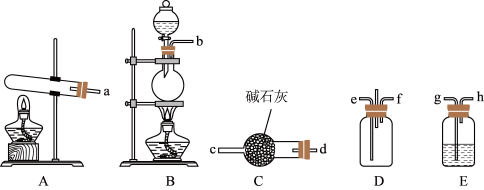
①写出用A装置制备NH3的化学方程式_______ 。
②为使NH3和HCl在D中充分混合并反应,上述装置的连接顺序为a→d→c→_______ 、_______ ←h←g←b。B中圆底烧瓶中放NaCl固体,则分液漏斗中的试剂为_______ 。
③装置D处除易堵塞导管外,还有不足之处为_______ 。
(2)该小组为探究Mg与NH4Cl溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。
资料:a.CH3COONH4溶液呈中性;b.Cl—对该反应几乎无影响。
①经检验实验2中刺激性气味气体为NH3,检验方法是_______ 。用排水法收集一小试管产生的气体,经检验小试管中气体为H2。
②已知灰白色沉淀中含有Mg2+、OH—。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。灰白色固体可能是_______ (填化学式)。
③甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
试剂X是_______ 。
④为进一步探究实验2反应剧烈的原因,进行实验4:
依据上述实验,可以得出Mg能与NH 反应生成H2.,乙同学认为该方案不严谨,需要补充的实验方案是
反应生成H2.,乙同学认为该方案不严谨,需要补充的实验方案是_______ 。
⑤实验总结:通过上述实验,该小组同学得出Mg能与NH 反应生成H2的结论。
反应生成H2的结论。
(1)该小组用NH3和HCl合成NH4Cl。

①写出用A装置制备NH3的化学方程式
②为使NH3和HCl在D中充分混合并反应,上述装置的连接顺序为a→d→c→
③装置D处除易堵塞导管外,还有不足之处为
(2)该小组为探究Mg与NH4Cl溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。
资料:a.CH3COONH4溶液呈中性;b.Cl—对该反应几乎无影响。
| 实验 | 实验试剂 | 实验现象 |
| 1 | 5mL蒸馏水 | 反应缓慢,有少量气泡产生 (经检验为H2) |
| 2 | 5mL 1.0mol/L NH4Cl溶液 (pH=4.6) | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
②已知灰白色沉淀中含有Mg2+、OH—。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。灰白色固体可能是
③甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
| 实验 | 实验装置 | 现象 |
| 3 | 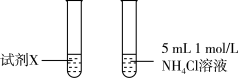 | 两试管反应剧烈程度相当 |
④为进一步探究实验2反应剧烈的原因,进行实验4:
| 实验 | 实验试剂 | 实验现象 |
| 4 | 5mL NH4Cl乙醇溶液 | 有无色无味气体产生 (经检验为H2) |
 反应生成H2.,乙同学认为该方案不严谨,需要补充的实验方案是
反应生成H2.,乙同学认为该方案不严谨,需要补充的实验方案是⑤实验总结:通过上述实验,该小组同学得出Mg能与NH
 反应生成H2的结论。
反应生成H2的结论。
您最近半年使用:0次
2022-03-07更新
|
1127次组卷
|
3卷引用:广东省广州市执信中学2022届高三下学期联考化学试题
广东省广州市执信中学2022届高三下学期联考化学试题广东省珠海市第二中学2021-2022学年高三下学期3000分第四次考试化学试题(已下线)第21练 新高考模式综合练(广东卷)-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
名校
解题方法
9 . 某同学设计实验验证 能还原CuO,装置(部分夹持仪器已省略)如图所示:
能还原CuO,装置(部分夹持仪器已省略)如图所示:
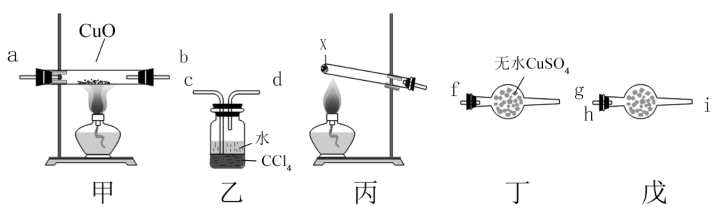
下列说法错误的是
 能还原CuO,装置(部分夹持仪器已省略)如图所示:
能还原CuO,装置(部分夹持仪器已省略)如图所示:
下列说法错误的是
A.试剂X可能是 和 和 的固体混合物 的固体混合物 |
| B.戊盛放的试剂可能是碱石灰,目的是防止空气进入装置 |
| C.装置按合理顺序连接为e→h→i→a→b→f→g→c |
D.证明 能还原CuO的实验现象是甲中黑色粉末变为红色,丁中白色固体变为蓝色 能还原CuO的实验现象是甲中黑色粉末变为红色,丁中白色固体变为蓝色 |
您最近半年使用:0次
2022-02-18更新
|
367次组卷
|
4卷引用:河北省桐柏县第一高级中学2021-2022学年高三上学期10月质量检测化学试题
10 . 下列关于硫和氮及其化合物的说法正确的是
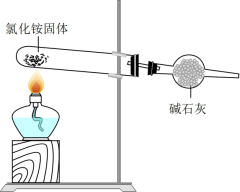

| A.NO2和SO2均为有刺激性气味的气体,是酸雨的主要成因 |
| B.SO2气体有还原性,故不能用浓硫酸干燥 |
| C.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 |
| D.实验室可用如图装置制取氨气 |
您最近半年使用:0次
2021-10-22更新
|
262次组卷
|
2卷引用:山东省潍坊第四中学2022届高三上学期收心考试化学试题



