名校
1 . Ⅰ.将50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:
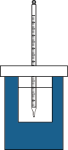
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______ 。
(2)中和热测定实验中,下列说法不正确的是_______。
(3)他们记录的实验数据如下:
(已知: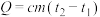 ,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为
,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为 )
)
①根据实验结果计算出NaOH溶液与HCl溶液反应的中和热
_______  。
。
②若实验过程中,内筒未加杯盖,求得的中和反应反应热数值_______ (填“偏大”“偏小”或“无影响”)。
③若用醋酸代替HCl做实验,对测定结果_______ (填“偏大”“偏小”或“无影响”)。
Ⅱ.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
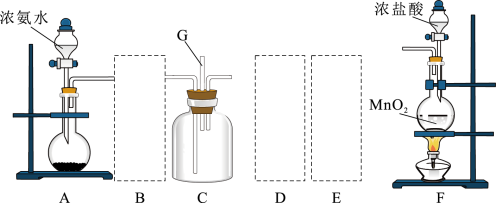
请回答下列问题:
(4)装置A中的烧瓶内固体不可选用_______(填字母)。
(5)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B、D、E从左至右依次选择的装置顺序为_______ 。
(6)氯气和氨气在常温下混合就能发生反应,现象为产生白烟,则C中反应的化学方程式为_______ 。
(7)某研究小组设计了一套制备及检验 部分性质的装置:
部分性质的装置:
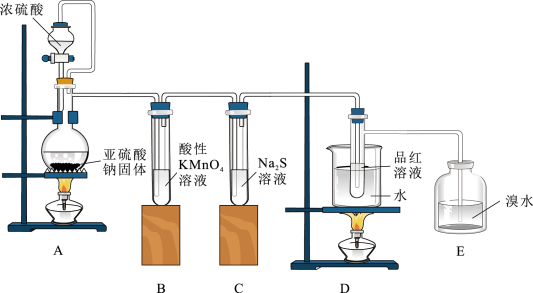
实验过程中观察到装置B中的现象是_______ ,反应的离子方程式为_______ ,C装置证明 具有
具有_______ 性。
(8)E中的化学反应方程式为_______ 。
(9)D装置的作用是_______ 。

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)中和热测定实验中,下列说法不正确的是_______。
| A.改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,求出的中和热数值和原来不同 |
| B.酸碱混合时,量筒中NaOH溶液应分三次倒入小烧杯中 |
| C.所加NaOH溶液过量,目的是保证盐酸完全被中和 |
| D.装置中隔热层的作用是保温隔热、减少热量损失 |
| 实验用品 | 溶液温度 | 中和热 | |||
 |  |  | |||
| ① | 50mL  NaOH溶液 NaOH溶液 | 50mL  HCl 溶液 HCl 溶液 | 20℃ | 23.3℃ | |
| ② | 50mL  NaOH溶液 NaOH溶液 | 50mL  HCl 溶液 HCl 溶液 | 20℃ | 23.5℃ | |
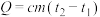 ,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为
,反应后溶液的比热容c为4.2kJ/(℃·kg),各物质的密度均为 )
)①根据实验结果计算出NaOH溶液与HCl溶液反应的中和热

 。
。②若实验过程中,内筒未加杯盖,求得的中和反应反应热数值
③若用醋酸代替HCl做实验,对测定结果
Ⅱ.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。

请回答下列问题:
(4)装置A中的烧瓶内固体不可选用_______(填字母)。
| A.碱石灰 | B.烧碱 | C.生石灰 | D.五氧化二磷 |
| 备选装置 | ||
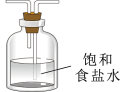 |  | 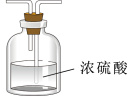 |
| Ⅰ | Ⅱ | Ⅲ |
(6)氯气和氨气在常温下混合就能发生反应,现象为产生白烟,则C中反应的化学方程式为
(7)某研究小组设计了一套制备及检验
 部分性质的装置:
部分性质的装置:
实验过程中观察到装置B中的现象是
 具有
具有(8)E中的化学反应方程式为
(9)D装置的作用是
您最近一年使用:0次
2022-05-18更新
|
519次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高一下学期期中考试(选考)化学试题
名校
2 . 四氮化四硫( ,S为
,S为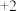 价)是重要的硫氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于
价)是重要的硫氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于 等有机溶剂,可用
等有机溶剂,可用 与
与 (红棕色液体)反应制备,反应装置如图所示(夹持装置已省略)。
(红棕色液体)反应制备,反应装置如图所示(夹持装置已省略)。
已知: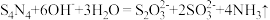
(1)氨气发生装置可以选用___________ (填字母)。 的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为
的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为___________ ;证明 反应完全的现象是
反应完全的现象是______________________ 。
(3)装置C的作用是___________________ ,其中 的作用是
的作用是______________ 。
(4)测定产品纯度:
i.蒸氨:取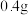 固体样品加入三颈烧瓶中,再加入足量
固体样品加入三颈烧瓶中,再加入足量 溶液并加热,将蒸出的
溶液并加热,将蒸出的 通入含有
通入含有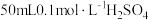 标准溶液的锥形瓶中。
标准溶液的锥形瓶中。
ii.滴定:用 的
的 溶液滴定剩余的
溶液滴定剩余的 ,记录消
,记录消 溶液的体积。重复实验3次,数据如下表所示:
溶液的体积。重复实验3次,数据如下表所示:
用 标准溶液滴定硫酸溶液之前,需要润洗滴定管,润洗滴定管的操作为
标准溶液滴定硫酸溶液之前,需要润洗滴定管,润洗滴定管的操作为______________________ ,滴定时选用的指示剂为___________ ,制得的 的纯度为
的纯度为___________ (保留两位有效数字)。
 ,S为
,S为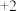 价)是重要的硫氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于
价)是重要的硫氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于 等有机溶剂,可用
等有机溶剂,可用 与
与 (红棕色液体)反应制备,反应装置如图所示(夹持装置已省略)。
(红棕色液体)反应制备,反应装置如图所示(夹持装置已省略)。已知:
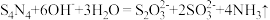
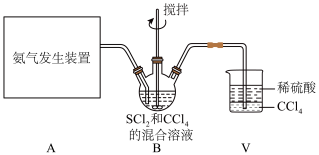
(1)氨气发生装置可以选用
a. 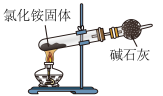 b.
b. c.
c. 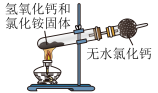 d.
d.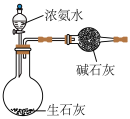
 的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为
的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为 反应完全的现象是
反应完全的现象是(3)装置C的作用是
 的作用是
的作用是(4)测定产品纯度:
i.蒸氨:取
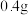 固体样品加入三颈烧瓶中,再加入足量
固体样品加入三颈烧瓶中,再加入足量 溶液并加热,将蒸出的
溶液并加热,将蒸出的 通入含有
通入含有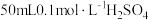 标准溶液的锥形瓶中。
标准溶液的锥形瓶中。ii.滴定:用
 的
的 溶液滴定剩余的
溶液滴定剩余的 ,记录消
,记录消 溶液的体积。重复实验3次,数据如下表所示:
溶液的体积。重复实验3次,数据如下表所示:实验序号 | 初始读数( | 最终读数( |
① | 0.20 | 20.22 |
② | 0.40 | 24.85 |
③ | 1.00 | 20.98 |
 标准溶液滴定硫酸溶液之前,需要润洗滴定管,润洗滴定管的操作为
标准溶液滴定硫酸溶液之前,需要润洗滴定管,润洗滴定管的操作为 的纯度为
的纯度为
您最近一年使用:0次
名校
解题方法
3 . 某实验小组的同学在实验室利用如图所示装置进行实验。
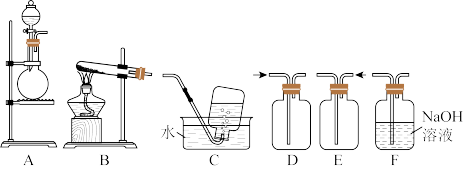
请回答下列问题:
(1)甲同学用装置 通过铜与浓硝酸反应制备
通过铜与浓硝酸反应制备 气体,上述装置中可用于收集
气体,上述装置中可用于收集 气体的是
气体的是_______ (填序号)。
(2)乙同学用图中的装置 通过铜与浓硫酸反应制取
通过铜与浓硫酸反应制取 气体,装置
气体,装置 中还缺少的仪器名称是
中还缺少的仪器名称是_______ ,该反应的化学方程式为_______ 。
(3)丙同学用装置 进行实验室制取氨气的实验,发生反应的化学方程式是
进行实验室制取氨气的实验,发生反应的化学方程式是_______ ;为了检验集气瓶中氨是否集满,可将湿润的红色石蕊试纸置于导管口,若_______ ,则证明已收集满;若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是_______ 则证明已收集满。
(4)丙同学在实验室中模拟氨的催化氧化反应,回答如下问题:
①该反应的化学方程式为_______ 。
②该反应中,当生成标准状况下 时,被氧化的物质的质量是
时,被氧化的物质的质量是_______  。
。

请回答下列问题:
(1)甲同学用装置
 通过铜与浓硝酸反应制备
通过铜与浓硝酸反应制备 气体,上述装置中可用于收集
气体,上述装置中可用于收集 气体的是
气体的是(2)乙同学用图中的装置
 通过铜与浓硫酸反应制取
通过铜与浓硫酸反应制取 气体,装置
气体,装置 中还缺少的仪器名称是
中还缺少的仪器名称是(3)丙同学用装置
 进行实验室制取氨气的实验,发生反应的化学方程式是
进行实验室制取氨气的实验,发生反应的化学方程式是(4)丙同学在实验室中模拟氨的催化氧化反应,回答如下问题:
①该反应的化学方程式为
②该反应中,当生成标准状况下
 时,被氧化的物质的质量是
时,被氧化的物质的质量是 。
。
您最近一年使用:0次
4 . 利用下列实验装置和试剂进行实验,能达到实验目的的是
 |  | 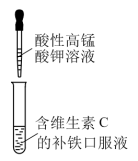 |  |
| A.铜与浓硝酸反应制NO2 | B.分离FeCl3溶液和氢氧化铁胶体 | C.证明补铁口服液中存在Fe2+ | D.加热NH4Cl固体制NH3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-02-09更新
|
601次组卷
|
4卷引用:黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高一下学期期中考试化学试题
名校
解题方法
5 . 现采用加热熟石灰与氯化铵的混合物的方法在实验室制备氨气,并进行有关氨气的性质实验。_____ 。
(2)B中盛放的试剂名称为_________ 。
(3)将D装置置于C处收集氨气,其中a口接______ (填“c”或“d”,下同),b口接_____ 。
(4)E中倒置漏斗的作用为_______ 。
(5)取下D装置,证明氨气已集满的操作和现象分别是___________ 。
(6)利用下图进喷泉实验。_____________ 。
②若该条件为标准状况,且水充满整个圆底烧瓶,则最终所得溶液的物质的量浓度为_______ 。

(2)B中盛放的试剂名称为
(3)将D装置置于C处收集氨气,其中a口接
(4)E中倒置漏斗的作用为
(5)取下D装置,证明氨气已集满的操作和现象分别是
(6)利用下图进喷泉实验。

②若该条件为标准状况,且水充满整个圆底烧瓶,则最终所得溶液的物质的量浓度为
您最近一年使用:0次
2021-06-23更新
|
222次组卷
|
3卷引用:黑龙江省牡丹江市第二高级中学2022-2023学年高一下学期4月月考化学试题
解题方法
6 . 氮及其化合物是重要的化工原料。
(1)写出实验室制氨气的化学方程式___________ ,证明氨气已集满的操作和现象是___________ 。
(2)含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
蛋白质 NH3
NH3 HNO2
HNO2 HNO3
HNO3 N2
N2
请回答:
①过程Ⅲ发生反应的化学方程式为____ 。
②根据图1和图2,判断使用亚硝化菌的最佳条件为_______ 。

③利用微生物处理含氮废水的优点为_______ 。
(3)肼(N2H4)暴露在空气中容易爆炸,但利用其制作的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等优点,其工作原理如图所示,写出该电池的正极反应式:_______ 。

(1)写出实验室制氨气的化学方程式
(2)含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
蛋白质
 NH3
NH3 HNO2
HNO2 HNO3
HNO3 N2
N2请回答:
①过程Ⅲ发生反应的化学方程式为
②根据图1和图2,判断使用亚硝化菌的最佳条件为

③利用微生物处理含氮废水的优点为
(3)肼(N2H4)暴露在空气中容易爆炸,但利用其制作的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等优点,其工作原理如图所示,写出该电池的正极反应式:

您最近一年使用:0次
7 . 根据实验室制NH3的反应原理和实验装置,回答下列问题。
(1)写出加热NH4Cl和Ca(OH)2制取NH3的化学方程式:_______ 。
(2)若要得到干燥的NH3,合适的干燥剂为_______ (填选项编号,下同)
a.浓硫酸 b.碱石灰 c.无水CaCl2 d.P2O5
(3)下列气体能用排水法收集的是_______ ,能用向上排空气法收集的是_______ 。
a.NH3 b.NO c.SO2
(4)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_______

(5)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_______ 溶液吸收多余的氯气,原理是_______ (用化学方程式表示)
(6)长期露置于空气中的漂白粉,加稀盐酸后产生的气体是_______ (填序号)。
A.O2 B.H2 C.CO2 D.HClO
(7)某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是_______ 。
(1)写出加热NH4Cl和Ca(OH)2制取NH3的化学方程式:
(2)若要得到干燥的NH3,合适的干燥剂为
a.浓硫酸 b.碱石灰 c.无水CaCl2 d.P2O5
(3)下列气体能用排水法收集的是
a.NH3 b.NO c.SO2
(4)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是

(5)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用
(6)长期露置于空气中的漂白粉,加稀盐酸后产生的气体是
A.O2 B.H2 C.CO2 D.HClO
(7)某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是
您最近一年使用:0次
8 . 氮及其化合物是重要的化工原料
(1)利用如图所示装置及药品制取氨气。

①A中制氨气的化学方程式是_______ 。
②C处是用集气瓶收集氨气的装置,请绘出装置图_____ 。
③证明氨气已集满的操作和现象是_______ 。
(2)氨经催化氧化可制备硝酸,其过程中涉及如下反应。4NH3+5O2 4NO+6H2O
4NO+6H2O
①作为氧化剂的物质是_______ ,氮元素的化合价_______ (填“升高”或“降低”)。
②若反应中消耗了4 mol NH3,则生成NO的物质的量_______ mol,转移电子的物质的量为_______ mol。
(1)利用如图所示装置及药品制取氨气。

①A中制氨气的化学方程式是
②C处是用集气瓶收集氨气的装置,请绘出装置图
③证明氨气已集满的操作和现象是
(2)氨经催化氧化可制备硝酸,其过程中涉及如下反应。4NH3+5O2
 4NO+6H2O
4NO+6H2O①作为氧化剂的物质是
②若反应中消耗了4 mol NH3,则生成NO的物质的量
您最近一年使用:0次
名校
解题方法
9 . 下列有关NH3的实验或结论正确的是
| A.NH3溶于水形成的溶液呈碱性,故NH3属于一元碱 |
| B.将湿润的红色石蕊试纸伸入集气瓶内,试纸变蓝则证明NH3已收集满 |
| C.将少量浓氨水滴入装有碱石灰的烧瓶中,可快速获得NH3 |
| D.将NH4HCO3热分解后的产物通过P2O5干燥管,可收集到干燥纯净的NH3 |
您最近一年使用:0次
2021-05-10更新
|
233次组卷
|
2卷引用:黑龙江省哈尔滨第六中学2020-2021学年高一下学期期中考试化学试题
名校
10 . 某课外实验小组设计的下列实验合理的是
A.制取氨气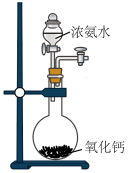 | B.制备并收集少量NO2气体 |
C.分离I2和NH4Cl  | D.证明非金属性:Cl>C>Si |
您最近一年使用:0次
2021-05-10更新
|
378次组卷
|
3卷引用:黑龙江省齐齐哈尔市第八中学2021-2022学年高一下学期期中考试化学试题

 )
)

