名校
解题方法
1 . 氨基甲酸铵是一种白色固体,易水解,是工业上生产尿素的副产物,可以用于药物合成。实验室向四氯化碳中通入干燥的二氧化碳和氨气制取氨基甲酸铵固体,实验装置如下图,反应的化学方程式为 。
。
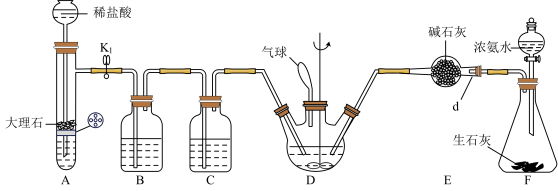
回答下列问题:
(1)仪器d的名称为
___________ ;装置F中发生反应的化学方程式为
___________ 。
(2)装置B中盛放的试剂为
___________ 。
(3)装置D中气球的作用是
___________ 。
(4)反应过程中需要将装置D放入冰水浴中,原因是
___________ 。
(5)氨基甲酸铵易水解,在潮湿的空气中发生水解反应生成碳酸氢铵的化学方程式为
________ 。
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品
 ,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为
,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为
 。则样品中氨基甲酸铵的物质的量分数为
。则样品中氨基甲酸铵的物质的量分数为
___________ 。(碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)。
 。
。
回答下列问题:
(1)仪器d的名称为
(2)装置B中盛放的试剂为
(3)装置D中气球的作用是
(4)反应过程中需要将装置D放入冰水浴中,原因是
(5)氨基甲酸铵易水解,在潮湿的空气中发生水解反应生成碳酸氢铵的化学方程式为
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品
 ,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为
,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为 。则样品中氨基甲酸铵的物质的量分数为
。则样品中氨基甲酸铵的物质的量分数为
您最近一年使用:0次
解题方法
2 . 氨基甲酸铵(H2NCOONH4)是一种重要的化工原料,可用作化学肥料、灭火剂、洗涤剂等。某化学兴趣小组用以下装置制取氨基甲酸铵。
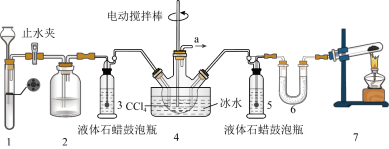
已知:①制取氨基甲酸铵反应为: 2NH3(g)+CO2(g)⇌H2NCOONH4(s) △H<0。
②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
回答下列问题:
(1)检查装置1气密性的操作是_______
(2)装置6中的试剂是_______ ,导管a出口直接与尾气处理装置连接,该尾气处理装置中的试剂是_______ 。
(3)装置7中发生反应的化学方程式为_______
(4)三颈烧瓶需用冰水浴冷却,其目的是_______
(5) CCl4液体中产生较多晶体悬浮物时,即停止反应。停止反应的操作是_______ ,从三颈烧瓶中分离出粗产品的操作是_______
(6)因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173g,用足量石灰水充分反应后,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为1.500g。样品中氨基甲酸铵的质量分数是_______ [Mr(H2NCOONH4)=78、Mr(NH4HCO3)=79]

已知:①制取氨基甲酸铵反应为: 2NH3(g)+CO2(g)⇌H2NCOONH4(s) △H<0。
②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
回答下列问题:
(1)检查装置1气密性的操作是
(2)装置6中的试剂是
(3)装置7中发生反应的化学方程式为
(4)三颈烧瓶需用冰水浴冷却,其目的是
(5) CCl4液体中产生较多晶体悬浮物时,即停止反应。停止反应的操作是
(6)因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173g,用足量石灰水充分反应后,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为1.500g。样品中氨基甲酸铵的质量分数是
您最近一年使用:0次
解题方法
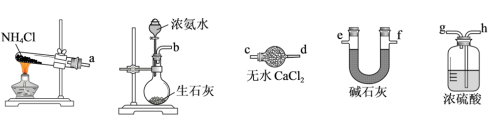
3 . 氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体、难溶于CCl4。实验室可将干燥二氧化碳和氨气通入CCl4中进行制备,反应原理为2NH3(g)+CO2(g)=NH2COONH4(s) △H<0,回答下列问题:
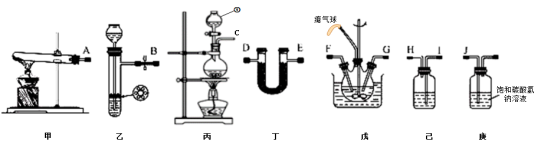
(1)仪器①的名称为_____ ,装置己中盛放的试剂为_____ 。
(2)简述检验装置乙气密性的操作_____ 。
(3)氨气的发生装置可以选择上图中的_____ ,制取氨气的化学方程式为_____ 。
(4)预制备产品,选择上图中必要的装置,其连接顺序为:发生装置→_____ →FG←_____ ←KJ←_____ (按气流方向,用大写字母表示)。
(5)为了提高氨基甲酸铵的产率.对三颈瓶采取的控温方法是_____ ,反应结束后,从反应后的混合物中分离出产品的实验操作是_____ ,戊中气球的作用是_____ 。
(6)氨基甲酸铵容易变质生成碳酸氢铵,现取长期存放的样品19.550g,用足量石灰水处理后,使样品中碳元素完全转化为碳酸钙,通过系列操作得纯净碳酸钙25.000g,则该样品的纯度为_____ %。(计算结果保留三位有效数字;有关物质的相对式量:氨基甲酸铵78、碳酸氢铵79、碳酸钙100) 。

(1)仪器①的名称为
(2)简述检验装置乙气密性的操作
(3)氨气的发生装置可以选择上图中的
(4)预制备产品,选择上图中必要的装置,其连接顺序为:发生装置→
(5)为了提高氨基甲酸铵的产率.对三颈瓶采取的控温方法是
(6)氨基甲酸铵容易变质生成碳酸氢铵,现取长期存放的样品19.550g,用足量石灰水处理后,使样品中碳元素完全转化为碳酸钙,通过系列操作得纯净碳酸钙25.000g,则该样品的纯度为
您最近一年使用:0次
4 . 氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体,难溶于CCl4。实验室可将干燥二氧化碳和干燥氨气通入CCl4中进行制备,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。
回答下列问题:
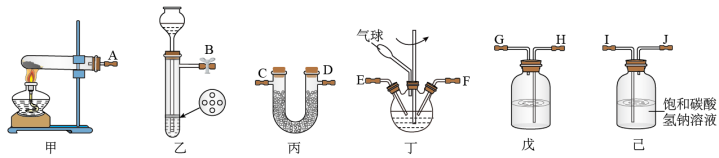
(1)利用装置甲制备氨气的化学方程式为__ 。
(2)简述检查装置乙气密性的操作__ 。
(3)选择图中的装置制备氨基甲酸铵,仪器接口的连接顺序为:B→__ →__ →EF←__ ←A。
(4)反应时为了增加氨基甲酸铵的产量,三颈瓶的加热方式为__ (填“热水浴”或“冷水浴”);丁中气球的作用是__ 。
(5)从装置丁的混合物中分离出产品的方法是__ (填写操作名称)。
(6)取因吸潮变质为碳酸氢铵的氨基甲酸铵样品11.730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的质量分数为__ (已知:Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100。计算结果保留3位有效数字)。
回答下列问题:

(1)利用装置甲制备氨气的化学方程式为
(2)简述检查装置乙气密性的操作
(3)选择图中的装置制备氨基甲酸铵,仪器接口的连接顺序为:B→
(4)反应时为了增加氨基甲酸铵的产量,三颈瓶的加热方式为
(5)从装置丁的混合物中分离出产品的方法是
(6)取因吸潮变质为碳酸氢铵的氨基甲酸铵样品11.730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的质量分数为
您最近一年使用:0次
2020-03-14更新
|
239次组卷
|
2卷引用:武汉市2020届高中毕业生学生质量检测化学试题
名校
解题方法
5 . 氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵:
反应式:2NH3(g)+CO2(g) H2NCOONH4△H <0
H2NCOONH4△H <0
(1)如果使用如图所示的装置制取NH3,你所选择的试剂是_____________ 。

(2)备氨基甲酸铵的装置如下图。把氨和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备:(注:四氯化碳与液体石蜡均为惰性介质。)
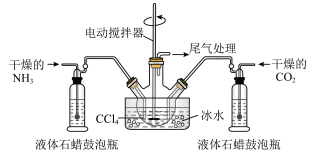
①发生器用冰水冷却的原因是_______ ,液体石蜡鼓泡瓶的作用是__________ ,发生反应的仪器名称是_______________ 。
②从反应后的混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是_____ (选填序号)
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(3)尾气有污染,可用________ 溶液吸收处理。
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵钱样品1.1730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。样品中氨基甲酸铵的物质的量分数为__________ 。[已知Mr(H2NCOONH4)=78, Mr(NH4HCO3)=79, Mr(CaCO3)=100]
反应式:2NH3(g)+CO2(g)
 H2NCOONH4△H <0
H2NCOONH4△H <0(1)如果使用如图所示的装置制取NH3,你所选择的试剂是

(2)备氨基甲酸铵的装置如下图。把氨和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备:(注:四氯化碳与液体石蜡均为惰性介质。)

①发生器用冰水冷却的原因是
②从反应后的混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(3)尾气有污染,可用
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵钱样品1.1730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。样品中氨基甲酸铵的物质的量分数为
您最近一年使用:0次
2017-03-15更新
|
810次组卷
|
3卷引用:2017届四川省成都市第七中学高三二诊模拟考试理综化学试卷
6 . 氮化铬(CrN)是一种良好的耐磨材料,实验室可用如下装置进行模拟制备(省略夹持装置):

Ⅰ.完成下列填空:
(1)干燥的NH3可选用以下装置制得,相应的连接顺序可以是_______→_______→_______(选填端口字母编号)。_______
Ⅱ.固体X可用无水氯化铬(CrCl3)固体,主要反应为NH3+CrCl3 CrN+3HCl。
CrN+3HCl。
(2)无水氯化铬具有很强的吸水性,通常形成晶体CrCl3·6H2O。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为_______ 。以氯化铬晶体制备无水氯化铬的方法是_______ 。
(3)实际进行实验时,发现上述装置存在一个缺陷,会导致危险,请简要说明。_______
Ⅲ.固体X也可用Cr2O3固体。通入NH3时先将氧化物还原为金属单质,然后金属单质与另一产物化合得到CrN,这些过程几乎同时进行。
(4)写出NH3与Cr2O3发生氧化还原反应的化学方程式:_______ 。
(5)CrN产品中含有Cr2N杂质,可利用如下方法进行纯度测定:取样品14.380g在空气中充分加热至反应完全,剩余固体全为Cr2O3,质量为16.720g。样品中CrN与Cr2N的物质的量之比为_______ 。
(6)证明样品已反应完全的操作名称是_______ ;若加热时长不足,则最终测定CrN的纯度将_______ (选填“偏大”“偏小”或“不变”)。

Ⅰ.完成下列填空:
(1)干燥的NH3可选用以下装置制得,相应的连接顺序可以是_______→_______→_______(选填端口字母编号)。

Ⅱ.固体X可用无水氯化铬(CrCl3)固体,主要反应为NH3+CrCl3
 CrN+3HCl。
CrN+3HCl。(2)无水氯化铬具有很强的吸水性,通常形成晶体CrCl3·6H2O。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为
(3)实际进行实验时,发现上述装置存在一个缺陷,会导致危险,请简要说明。
Ⅲ.固体X也可用Cr2O3固体。通入NH3时先将氧化物还原为金属单质,然后金属单质与另一产物化合得到CrN,这些过程几乎同时进行。
(4)写出NH3与Cr2O3发生氧化还原反应的化学方程式:
(5)CrN产品中含有Cr2N杂质,可利用如下方法进行纯度测定:取样品14.380g在空气中充分加热至反应完全,剩余固体全为Cr2O3,质量为16.720g。样品中CrN与Cr2N的物质的量之比为
(6)证明样品已反应完全的操作名称是
您最近一年使用:0次



