名校
1 . 氨基甲酸铵( )是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
)是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
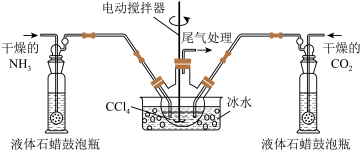
已知:①制取氨基甲酸铵反应为: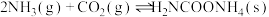
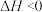 。
。
②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
③四氯化碳与液体石蜡均为惰性介质。
回答下列问题:
(1)若用如图所示装置制取氨气,你所选择的试剂是_______ 。
(2)液体石蜡鼓泡瓶的作用是_______ ,尾气处理装置中的试剂是_______ 。
(3)三颈烧瓶需用冰水浴冷却,其目的是_______ 。
(4) 液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是
液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是_______ 。
(5)将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡: 。可以判断该反应已经达到平衡的是_______。
。可以判断该反应已经达到平衡的是_______。
(6)因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173g,用足量石灰水充分反应后,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为1.500g。样品中氨基甲酸铵的质量分数是_______ 。(计算结果保留四位有效数字)[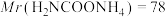 、
、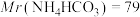 ]
]
 )是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
)是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
已知:①制取氨基甲酸铵反应为:
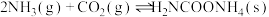
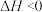 。
。②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
③四氯化碳与液体石蜡均为惰性介质。
回答下列问题:
(1)若用如图所示装置制取氨气,你所选择的试剂是

(2)液体石蜡鼓泡瓶的作用是
(3)三颈烧瓶需用冰水浴冷却,其目的是
(4)
 液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是
液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是(5)将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:
 。可以判断该反应已经达到平衡的是_______。
。可以判断该反应已经达到平衡的是_______。A. |
| B.容器中总压强不变 |
| C.容器中混合气体的平均相对分子质量不变 |
| D.容器中氨气的体积分数不变 |
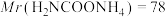 、
、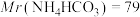 ]
]
您最近一年使用:0次
2022-11-01更新
|
162次组卷
|
2卷引用:山西大学附属中学校2023-2024学年高二上学期10月模块诊断化学试题
名校
2 . 氨基甲酸铵(H2NCOONH4)是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置制取氨基甲酸铵。
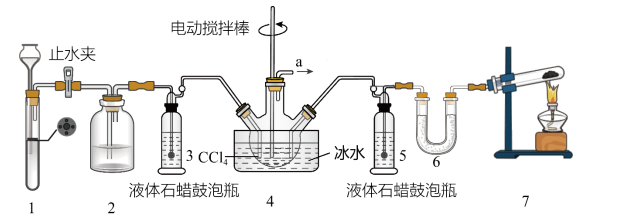
已知:①制取氨基甲酸铵反应为:2NH3(g)+CO2(g) H2NCOONH4(s) △H<0。
H2NCOONH4(s) △H<0。
②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
回答下列问题:
(1)检查装置1气密性的操作是______ 。
(2)装置6中的试剂是_____ ,导管a出口直接与尾气处理装置连接,该尾气处理装置中的试剂是______ 。
(3)装置7中发生反应的化学方程式为_____ 。
(4)三颈烧瓶需用冰水浴冷却,其目的是_____ 。
(5)CCl4液体中产生较多晶体悬浮物时,即停止反应。停止反应的操作是_____ ,从三颈烧瓶中分离出粗产品的操作是_____ 。
(6)因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173g,用足量石灰水充分反应后,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为1.500g。写出石灰水与氨基甲酸铵反应转化为碳酸钙的反应方程式____ 。样品中氨基甲酸铵的质量分数是_____ 。(计算结果保留小数点后两位)[Mr(H2NCOONH4)=78、Mr(NH4HCO3)=79]

已知:①制取氨基甲酸铵反应为:2NH3(g)+CO2(g)
 H2NCOONH4(s) △H<0。
H2NCOONH4(s) △H<0。②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
回答下列问题:
(1)检查装置1气密性的操作是
(2)装置6中的试剂是
(3)装置7中发生反应的化学方程式为
(4)三颈烧瓶需用冰水浴冷却,其目的是
(5)CCl4液体中产生较多晶体悬浮物时,即停止反应。停止反应的操作是
(6)因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173g,用足量石灰水充分反应后,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为1.500g。写出石灰水与氨基甲酸铵反应转化为碳酸钙的反应方程式
您最近一年使用:0次
3 . 氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体,难溶于CCl4。实验室可将干燥二氧化碳和干燥氨气通入CCl4中进行制备,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。
回答下列问题:
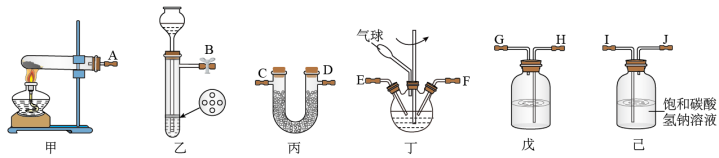
(1)利用装置甲制备氨气的化学方程式为__ 。
(2)简述检查装置乙气密性的操作__ 。
(3)选择图中的装置制备氨基甲酸铵,仪器接口的连接顺序为:B→__ →__ →EF←__ ←A。
(4)反应时为了增加氨基甲酸铵的产量,三颈瓶的加热方式为__ (填“热水浴”或“冷水浴”);丁中气球的作用是__ 。
(5)从装置丁的混合物中分离出产品的方法是__ (填写操作名称)。
(6)取因吸潮变质为碳酸氢铵的氨基甲酸铵样品11.730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的质量分数为__ (已知:Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100。计算结果保留3位有效数字)。
回答下列问题:

(1)利用装置甲制备氨气的化学方程式为
(2)简述检查装置乙气密性的操作
(3)选择图中的装置制备氨基甲酸铵,仪器接口的连接顺序为:B→
(4)反应时为了增加氨基甲酸铵的产量,三颈瓶的加热方式为
(5)从装置丁的混合物中分离出产品的方法是
(6)取因吸潮变质为碳酸氢铵的氨基甲酸铵样品11.730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的质量分数为
您最近一年使用:0次
2020-03-14更新
|
239次组卷
|
2卷引用:辽宁省辽河油田第二高级中学2020届高三4月模拟考试理综化学试题
解题方法
4 . 三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
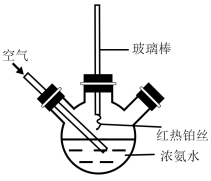
(1)在如图所示装置中,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中NH3∙H2O的电离程度____ (填“变大”、“变小”或“不变”)
Ⅱ.实验室用下图所示装置制备氨基甲酸铵(NH2COONH4),其反应化学方程式:2NH3(g)+CO2(g) NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
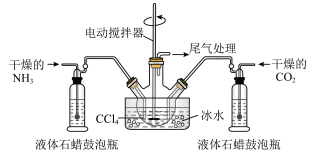
(2)写出加入药品之前实验操作的要点_______ ;反应中若有水存在则生成碳酸氢铵的化学方程式是________________________ 。
(3)干燥管中盛放的药品是______ 。简述左侧三颈瓶装置制取氨气的原理________ 。
(4)对比碳酸盐和酸的反应制取CO2,该实验利用干冰升华产生气体CO2的有优点有_____ .
(5)有同学认为该实验装置存在安全问题,请问可能面临的安全问题是________ 。
(6)氨基甲酸氨可用作肥料,其肥效比尿素[CO(NH2)2]_______ (填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________ 。
(1)在如图所示装置中,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中NH3∙H2O的电离程度

Ⅱ.实验室用下图所示装置制备氨基甲酸铵(NH2COONH4),其反应化学方程式:2NH3(g)+CO2(g)
 NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(2)写出加入药品之前实验操作的要点
(3)干燥管中盛放的药品是
(4)对比碳酸盐和酸的反应制取CO2,该实验利用干冰升华产生气体CO2的有优点有
(5)有同学认为该实验装置存在安全问题,请问可能面临的安全问题是
(6)氨基甲酸氨可用作肥料,其肥效比尿素[CO(NH2)2]
您最近一年使用:0次
名校
解题方法
5 . 氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵:
反应式:2NH3(g)+CO2(g) H2NCOONH4△H <0
H2NCOONH4△H <0
(1)如果使用如图所示的装置制取NH3,你所选择的试剂是_____________ 。

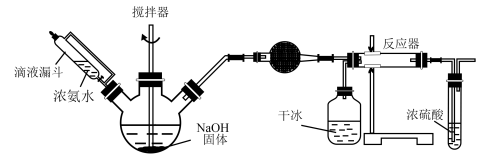
(2)备氨基甲酸铵的装置如下图。把氨和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备:(注:四氯化碳与液体石蜡均为惰性介质。)
①发生器用冰水冷却的原因是_______ ,液体石蜡鼓泡瓶的作用是__________ ,发生反应的仪器名称是_______________ 。
②从反应后的混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是_____ (选填序号)
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(3)尾气有污染,可用________ 溶液吸收处理。
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵钱样品1.1730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。样品中氨基甲酸铵的物质的量分数为__________ 。[已知Mr(H2NCOONH4)=78, Mr(NH4HCO3)=79, Mr(CaCO3)=100]
反应式:2NH3(g)+CO2(g)
 H2NCOONH4△H <0
H2NCOONH4△H <0(1)如果使用如图所示的装置制取NH3,你所选择的试剂是

(2)备氨基甲酸铵的装置如下图。把氨和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备:(注:四氯化碳与液体石蜡均为惰性介质。)

①发生器用冰水冷却的原因是
②从反应后的混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(3)尾气有污染,可用
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵钱样品1.1730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。样品中氨基甲酸铵的物质的量分数为
您最近一年使用:0次
2017-03-15更新
|
810次组卷
|
3卷引用:四川省双流中学2018届高三11月月考理科综合化学试题
6 . 工业上用饱和食盐水吸收尾气 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):

已知:浓硫酸的沸点为338℃。回答下列问题:
(1)导气管b的作用___________ 。
(2)装置B中发生的化学反应的化学方程式为___________ 。
(3)固、固加热制取氨气的发生装置可以选择下图中的___________ (填编号),反应的化学方程式为___________ 。
C. D.
D. E.
E. F.
F.
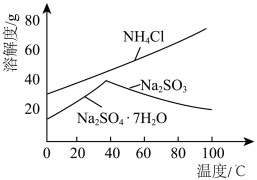
(4)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得___________ ,然后将滤液___________ 、过滤、洗涤、干燥可得另一产物。
(5)产品中可能混有少量 和
和 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是___________ ,检验产品中含有 的的实验方法:取少量样品于试管中,加入适量水溶解,
的的实验方法:取少量样品于试管中,加入适量水溶解,___________ 。
【可选试剂:稀硝酸、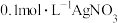 溶液、酸性
溶液、酸性 溶液、
溶液、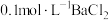 溶液、
溶液、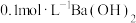 溶液、
溶液、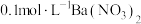 溶液】
溶液】
 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
已知:浓硫酸的沸点为338℃。回答下列问题:
(1)导气管b的作用
(2)装置B中发生的化学反应的化学方程式为
(3)固、固加热制取氨气的发生装置可以选择下图中的
C.
 D.
D. E.
E. F.
F.
(4)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得

(5)产品中可能混有少量
 和
和 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是 的的实验方法:取少量样品于试管中,加入适量水溶解,
的的实验方法:取少量样品于试管中,加入适量水溶解,【可选试剂:稀硝酸、
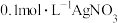 溶液、酸性
溶液、酸性 溶液、
溶液、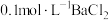 溶液、
溶液、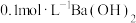 溶液、
溶液、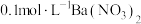 溶液】
溶液】
您最近一年使用:0次
解题方法
7 . 四氮化四硫(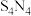 ,S为+2价)是重要的硫-氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于
,S为+2价)是重要的硫-氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于 等有机溶剂,可用
等有机溶剂,可用 与
与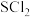 (红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
(红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
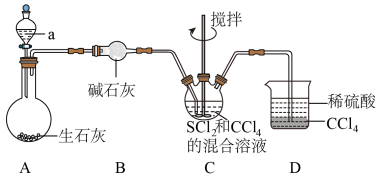
已知:
回答下列问题;
(1)试剂a是___________ (填化学式);B中的碱石灰___________ 用五氧化二磷代替(填“能”或“不能”)。
(2)装置C中生成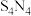 的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为
的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为___________ ;证明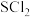 反应完全的现象是
反应完全的现象是___________ 。
(3)分离产物后测定产品纯度:
i.蒸氨:取0.1000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热,蒸出的 。通入含有
。通入含有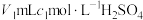 标准溶液的锥形瓶中。
标准溶液的锥形瓶中。
ii.滴定:用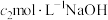 溶液滴定剩余的
溶液滴定剩余的 ,消耗
,消耗 溶液。
溶液。
①若滴定时选用酚酞作指示剂,滴定终点的现象为___________ 。
②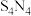 的纯度表达式为
的纯度表达式为___________ (用质量分数表示);若配制NaOH溶液时称量时间过长,测定结果___________ (填“偏高”“偏低”或“无影响”)。
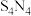 ,S为+2价)是重要的硫-氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于
,S为+2价)是重要的硫-氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于 等有机溶剂,可用
等有机溶剂,可用 与
与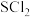 (红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
(红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
已知:

回答下列问题;
(1)试剂a是
(2)装置C中生成
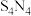 的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为
的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为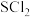 反应完全的现象是
反应完全的现象是(3)分离产物后测定产品纯度:
i.蒸氨:取0.1000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热,蒸出的
 。通入含有
。通入含有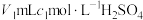 标准溶液的锥形瓶中。
标准溶液的锥形瓶中。ii.滴定:用
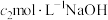 溶液滴定剩余的
溶液滴定剩余的 ,消耗
,消耗 溶液。
溶液。①若滴定时选用酚酞作指示剂,滴定终点的现象为
②
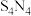 的纯度表达式为
的纯度表达式为
您最近一年使用:0次
名校
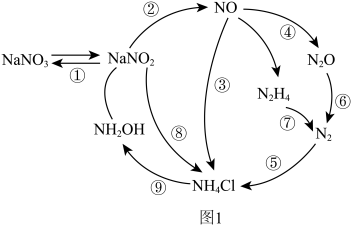
8 . 近年来,人们对微生物的氮转化进行了深入研究,将其归纳为如图1所示过程。请回答下列问题:
(1)N2的电子式为_____ ;羟胺(NH2OH)的结构式为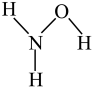 ,属于
,属于_____ (填“离子”或“共价”)化合物。
(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:_____ 。
(3)图1转化过程中具有固氮功能的是_____ (填标号)。
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。
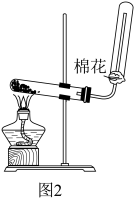
I.写出该反应的化学方程式:_____ 。
Ⅱ.棉花的作用为_____ 。
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。
I.请配平该离子方程式:_____ 。
Ⅱ.NaNO2的质量分数为_____ %。

(1)N2的电子式为
 ,属于
,属于(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:
(3)图1转化过程中具有固氮功能的是
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。

I.写出该反应的化学方程式:
Ⅱ.棉花的作用为
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO
 +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。I.请配平该离子方程式:
Ⅱ.NaNO2的质量分数为
您最近一年使用:0次
2023-04-18更新
|
403次组卷
|
3卷引用:辽宁省部分学校联考2022-2023学年高一下学期4月月考化学试题
名校
解题方法
9 . 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,合成氨是人类发展史上的一项重大突破。某化学兴趣小组对氨气进行研究:
I. 催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如下图所示:
催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如下图所示:
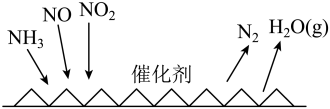
(1)SCR催化反应器中 还原
还原 的化学方程式为
的化学方程式为_______ 。
II.用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。

(2)若氨气的发生装置选择A,则其化学反应方程式为_______ 。
(3)若要用C装置来干燥 ,可以选用的干燥剂为
,可以选用的干燥剂为_______ 。
(4)上述D、E、F、G装置可用于作为氨气的尾气处理装置的是_______ 。
(5)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
已知:CuO在高温时不稳定,会自身分解得到红色的

①实验结束后H处硬质玻璃管中黑色粉末变成红色,该红色粉末的成分能否确定?_______ (填“能”或“否”)。请通过检验其他产物证明 和CuO发生了反应,简述实验方案:
和CuO发生了反应,简述实验方案:_______ 。
②若经实验测定 和CuO反应的产物有Cu和无污染气体,则
和CuO反应的产物有Cu和无污染气体,则 和CuO反应的化学方程式为
和CuO反应的化学方程式为_______ 。
(6)已知加热条件下,氨气可以与铝发生置换反应生成AlN;AlN性质稳定,加热时溶于浓碱溶液且可产生氨气。称取AlN样品23.2 g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56 L(标准状况),则样品中AlN的质量分数为_______ %(保留一位小数)。
I.
 催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如下图所示:
催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如下图所示:
(1)SCR催化反应器中
 还原
还原 的化学方程式为
的化学方程式为II.用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。

(2)若氨气的发生装置选择A,则其化学反应方程式为
(3)若要用C装置来干燥
 ,可以选用的干燥剂为
,可以选用的干燥剂为(4)上述D、E、F、G装置可用于作为氨气的尾气处理装置的是
(5)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
已知:CuO在高温时不稳定,会自身分解得到红色的


①实验结束后H处硬质玻璃管中黑色粉末变成红色,该红色粉末的成分能否确定?
 和CuO发生了反应,简述实验方案:
和CuO发生了反应,简述实验方案:②若经实验测定
 和CuO反应的产物有Cu和无污染气体,则
和CuO反应的产物有Cu和无污染气体,则 和CuO反应的化学方程式为
和CuO反应的化学方程式为(6)已知加热条件下,氨气可以与铝发生置换反应生成AlN;AlN性质稳定,加热时溶于浓碱溶液且可产生氨气。称取AlN样品23.2 g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56 L(标准状况),则样品中AlN的质量分数为
您最近一年使用:0次
2023-03-07更新
|
716次组卷
|
2卷引用:湖南省长沙市第一中学2022-2023学年高一下学期第一次月考(3月)化学试题
名校
10 . 氨基甲酸铵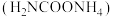 是一种易水解且受热易分解的白色固体,易溶于水,难溶于
是一种易水解且受热易分解的白色固体,易溶于水,难溶于 ,某研究小组用如图所示的实验装置制备氨基甲酸铵。
,某研究小组用如图所示的实验装置制备氨基甲酸铵。
反应原理: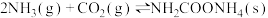

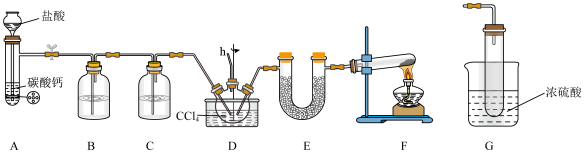
(1)仪器组装完毕后,首先应进行的操作是___________ ,仪器F中发生反应的化学方程式为___________ 。
(2)装置B中所盛的试剂是___________ 溶液,E中所盛的药品可以是___________ (填序号)。
A碱石灰 B.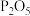 C.无水氯化钙 D.浓硫酸
C.无水氯化钙 D.浓硫酸
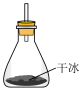
(3)对比本实验装置,有同学用如图所示装置来代替产生 气体,其优点有___________(填序号)。
气体,其优点有___________(填序号)。
(4)反应过程中需要将装置D放入冰水浴中,从原料转化率和产物纯度的角度分析,原因可能是___________ 、___________ 。
(5)导管h一般与装置G相连,则装置G除了能防倒吸,还具有的作用是___________ 。
(6)产品纯度分析:称取产品3.91g(内含杂质 ),加入足量石灰水充分反应,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为5.00g,则样品中氨基甲酸铵的质量分数是
),加入足量石灰水充分反应,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为5.00g,则样品中氨基甲酸铵的质量分数是___________ (计算结果保留小数点后两位)。[摩尔质量: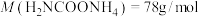 、
、 ]
]
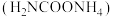 是一种易水解且受热易分解的白色固体,易溶于水,难溶于
是一种易水解且受热易分解的白色固体,易溶于水,难溶于 ,某研究小组用如图所示的实验装置制备氨基甲酸铵。
,某研究小组用如图所示的实验装置制备氨基甲酸铵。反应原理:
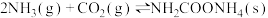


(1)仪器组装完毕后,首先应进行的操作是
(2)装置B中所盛的试剂是
A碱石灰 B.
 C.无水氯化钙 D.浓硫酸
C.无水氯化钙 D.浓硫酸(3)对比本实验装置,有同学用如图所示装置来代替产生
 气体,其优点有___________(填序号)。
气体,其优点有___________(填序号)。
| A.装置简单,操作方便 |
B.避免了 的净化和干燥处理 的净化和干燥处理 |
| C.加快了氨基甲酸胺的生成速率 |
D.对 的流速有更好的调控和掌握 的流速有更好的调控和掌握 |
(5)导管h一般与装置G相连,则装置G除了能防倒吸,还具有的作用是
(6)产品纯度分析:称取产品3.91g(内含杂质
 ),加入足量石灰水充分反应,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为5.00g,则样品中氨基甲酸铵的质量分数是
),加入足量石灰水充分反应,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为5.00g,则样品中氨基甲酸铵的质量分数是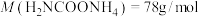 、
、 ]
]
您最近一年使用:0次



