名校
解题方法
1 . 设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。
ⅱ. 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。
某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,
溶液,___________ (填实验现象)。
上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是___________
(3)写出NO与碱性 溶液反应的离子方程式
溶液反应的离子方程式___________
(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: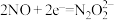 ,则氧化反应为:
,则氧化反应为:___________ 。
(5)某同学结合所学知识设计处理工业废气中 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式___________
②再向生成的溶液中加入一定量___________ ,以此溶液来吸收NO气体。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性
 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。资料:ⅰ.NO与碱性
 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。ⅱ.
 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和
 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴
 的
的 溶液,
溶液,上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是
(3)写出NO与碱性
 溶液反应的离子方程式
溶液反应的离子方程式(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性
 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: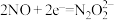 ,则氧化反应为:
,则氧化反应为:(5)某同学结合所学知识设计处理工业废气中
 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。①先用饱和纯碱溶液吸收废气中的
 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式②再向生成的溶液中加入一定量
您最近一年使用:0次
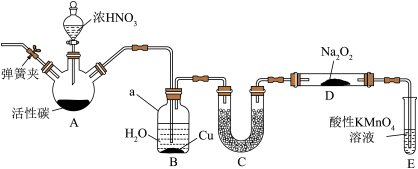
2 . 某些资料认为NO、NO2不能与Na2O2反应。南开中学化学学习小组提出质疑,他们分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设I:过氧化钠氧化二氧化氮,生成NaNO3;
假设II:二氧化氮氧化过氧化钠,生成O2。
(1)小组甲同学设计实验如下:
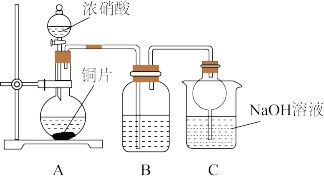
①试管A中反应的化学方程式是__________ 。
②待试管B中收集满气体,向试管B中加入适量Na2O2,塞紧塞子,振荡试管,观察到红棕色气体迅速消失;再将带火星木条迅速伸进试管内,木条复燃。甲同学认为假设II正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个浓硫酸洗气装置,该装置的作用是_______ 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星木条未复燃。得出结论:假设I正确。NO2和Na2O2反应的方程式是________ 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:①2NO+Na2O2=2NaNO2
②亚硝酸盐在酸性条件下不稳定:2H++3 =
= +2NO↑+H2O。
+2NO↑+H2O。
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
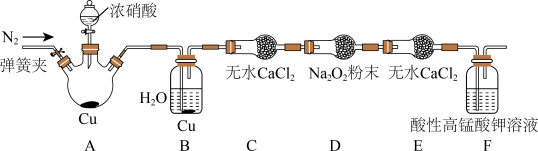
①在反应前,打开弹簧夹,通入一段时间N2,目的是_________ 。
②充分反应后,取D装置中产物少许,加入稀盐酸,若观察到________ 现象,则产物是亚硝酸钠。
③F装置的作用是________ 。该装置中发生反应的离子方程式为_________ 。
假设I:过氧化钠氧化二氧化氮,生成NaNO3;
假设II:二氧化氮氧化过氧化钠,生成O2。
(1)小组甲同学设计实验如下:

①试管A中反应的化学方程式是
②待试管B中收集满气体,向试管B中加入适量Na2O2,塞紧塞子,振荡试管,观察到红棕色气体迅速消失;再将带火星木条迅速伸进试管内,木条复燃。甲同学认为假设II正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个浓硫酸洗气装置,该装置的作用是
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星木条未复燃。得出结论:假设I正确。NO2和Na2O2反应的方程式是
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:①2NO+Na2O2=2NaNO2
②亚硝酸盐在酸性条件下不稳定:2H++3
 =
= +2NO↑+H2O。
+2NO↑+H2O。丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①在反应前,打开弹簧夹,通入一段时间N2,目的是
②充分反应后,取D装置中产物少许,加入稀盐酸,若观察到
③F装置的作用是
您最近一年使用:0次
2014·北京顺义·二模
名校
解题方法
3 . 某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:

假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是_________ 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是________ 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是_______ 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:① 2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2 SO4+ 2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①B中观察到的主要现象是__________ ,F装置的作用是_________ 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是________ 。
③充分反应后,检验D装置中发生反应的实验是________ 。

假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:① 2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2 SO4+ 2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①B中观察到的主要现象是
②在反应前,打开弹簧夹,通入一段时间N2,目的是
③充分反应后,检验D装置中发生反应的实验是
您最近一年使用:0次
名校
解题方法
4 . 下列实验操作、实验现象和实验结论均正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 将两支分别蘸有浓氨水和浓硫酸的玻璃棒靠近 | 冒白烟 | 挥发出的NH3与H2SO4生成(NH4)2SO4固体 |
| B | 用玻璃棒蘸取浓HNO3点到蓝色石蕊试纸上 | 试纸先变红后褪色 | 浓HNO3具有酸性和强氧化性 |
| C | 用Cu与稀硝酸反应制备NO,并用向下排空法收集气体 | 铜片溶解,有无色气体生成,得到蓝色溶液 | 稀硝酸具有强氧化性 |
| D | 加热NH4HCO3的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-21更新
|
142次组卷
|
2卷引用:江苏省常州市联盟校2023-2024学年高一下学期3月阶段调研化学试题
5 . 亚硝酸钠(NaNO2)是一种常见的食品添加剂。某实验小组制备NaNO2并对其性质进行探究。
资料:Ag+与NO 反应,可生成AgNO2白色沉淀或无色配离子。
反应,可生成AgNO2白色沉淀或无色配离子。
Ⅰ. NaNO2的制取(夹持装置略)
实验i
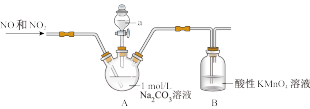
向装置A中通入一段时间N2,再通入NO和NO2混合气体,待Na2CO3反应完全后,将所得溶液经系列操作,得到NaNO2白色固体。
(1)仪器a的名称是______ 。
(2)制取NaNO2的离子方程式是______ 。
(3)小组成员推测HNO2是弱酸。为证实推测,向NaNO2溶液中加入试剂X,“实验现象”证实该推测合理,加入的试剂及现象是______ 。
Ⅱ. NaNO2性质探究
将实验ⅰ制取的NaNO2固体配制成约0.1 mol/L NaNO2溶液,进行实验ⅱ和ⅲ。
实验ii

(4)①由实验ⅱ的现象得出结论:白色沉淀的生成与______ 有关。
②仅用实验ⅱ的试剂,设计不同实验方案进一步证实了上述结论,实验操作及现象是______ 。
(5)① 酸性条件下,NO 氧化I-的离子方程式是
氧化I-的离子方程式是______ 。
实验iii
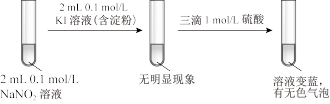
②甲同学认为,依据实验ⅲ的现象可以得出结论:该条件下,NO 能氧化I-。乙同学则认为A装置中制取的NaNO2含有副产物,仅凭实验ⅲ不能得出上述结论,还需要补充实验iv进行验证,乙同学设计实验iv证明了实验ⅲ条件下氧化I-的只有NO
能氧化I-。乙同学则认为A装置中制取的NaNO2含有副产物,仅凭实验ⅲ不能得出上述结论,还需要补充实验iv进行验证,乙同学设计实验iv证明了实验ⅲ条件下氧化I-的只有NO ,实验iv的实验方案是
,实验iv的实验方案是______ 。
资料:Ag+与NO
 反应,可生成AgNO2白色沉淀或无色配离子。
反应,可生成AgNO2白色沉淀或无色配离子。Ⅰ. NaNO2的制取(夹持装置略)
实验i

向装置A中通入一段时间N2,再通入NO和NO2混合气体,待Na2CO3反应完全后,将所得溶液经系列操作,得到NaNO2白色固体。
(1)仪器a的名称是
(2)制取NaNO2的离子方程式是
(3)小组成员推测HNO2是弱酸。为证实推测,向NaNO2溶液中加入试剂X,“实验现象”证实该推测合理,加入的试剂及现象是
Ⅱ. NaNO2性质探究
将实验ⅰ制取的NaNO2固体配制成约0.1 mol/L NaNO2溶液,进行实验ⅱ和ⅲ。
实验ii

(4)①由实验ⅱ的现象得出结论:白色沉淀的生成与
②仅用实验ⅱ的试剂,设计不同实验方案进一步证实了上述结论,实验操作及现象是
(5)① 酸性条件下,NO
 氧化I-的离子方程式是
氧化I-的离子方程式是实验iii
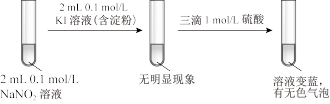
②甲同学认为,依据实验ⅲ的现象可以得出结论:该条件下,NO
 能氧化I-。乙同学则认为A装置中制取的NaNO2含有副产物,仅凭实验ⅲ不能得出上述结论,还需要补充实验iv进行验证,乙同学设计实验iv证明了实验ⅲ条件下氧化I-的只有NO
能氧化I-。乙同学则认为A装置中制取的NaNO2含有副产物,仅凭实验ⅲ不能得出上述结论,还需要补充实验iv进行验证,乙同学设计实验iv证明了实验ⅲ条件下氧化I-的只有NO ,实验iv的实验方案是
,实验iv的实验方案是
您最近一年使用:0次
6 . 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3 mol·L-1稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳气体
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、⑥中盛放的药品依次是________ 、_______ 。
(2)滴加浓硝酸之前的操作是a.检验装置的气密性,b.加入药品,c.打开弹簧夹,d._______ 。
(3)装置①中发生反应的化学方程式是________________ 。
(4)装置②的作用是____________________ 。
(5)该小组得出的结论所依据的实验现象是_________________ 。
(6) 实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液 中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)______ 。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化

可选药品:浓硝酸、3 mol·L-1稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳气体
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、⑥中盛放的药品依次是
(2)滴加浓硝酸之前的操作是a.检验装置的气密性,b.加入药品,c.打开弹簧夹,d.
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是
(5)该小组得出的结论所依据的实验现象是
(6) 实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液 中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
您最近一年使用:0次
7 .  、
、 等均为大气污染物,需处理后才能排放。
等均为大气污染物,需处理后才能排放。
I.某研究性小组探究NO与炽热的铜粉反应,设计如下: ,
, 被还原成Mn2+。
被还原成Mn2+。
(1)实验开始前,检查装置气密性涉及以下操作:将F中的长导管插入液面以下→___________→___________→___________→___________→______________________ (操作可重复使用)。(填序号)
①关闭弹簧夹a,打开弹簧夹b ②观察F中的现象
③用酒精灯加热A中三颈烧瓶 ④撤走酒精灯
(2)装置B的作用为___________ ,实验结束时需通一段时间的N2,目的是___________ 。
(3)反应一段时间后,装置D中铜粉变黑,写出发生反应的化学方程式___________ 。
(4)实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为___________ 。
II.煤的洁净技术(包括固硫技术和脱硫技术)可有效降低燃煤废气中SO2的含量,通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。
(5)生石灰是常用的固硫剂,SO2与生石灰反应将转化成___________ ;用碱液吸收SO2也是一种常用的脱硫方法,用1L 1.0 mol/L NaOH溶液吸收0.8mol SO2,所得溶液中的SO 和HSO
和HSO 的物质的量浓度之比是
的物质的量浓度之比是___________ 。
 、
、 等均为大气污染物,需处理后才能排放。
等均为大气污染物,需处理后才能排放。I.某研究性小组探究NO与炽热的铜粉反应,设计如下:
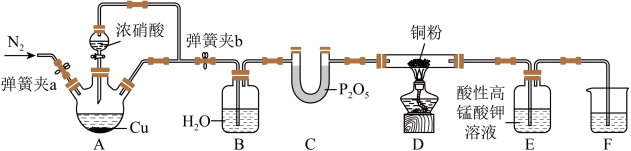
 ,
, 被还原成Mn2+。
被还原成Mn2+。(1)实验开始前,检查装置气密性涉及以下操作:将F中的长导管插入液面以下→___________→___________→___________→___________→___________
①关闭弹簧夹a,打开弹簧夹b ②观察F中的现象
③用酒精灯加热A中三颈烧瓶 ④撤走酒精灯
(2)装置B的作用为
(3)反应一段时间后,装置D中铜粉变黑,写出发生反应的化学方程式
(4)实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为
II.煤的洁净技术(包括固硫技术和脱硫技术)可有效降低燃煤废气中SO2的含量,通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。
(5)生石灰是常用的固硫剂,SO2与生石灰反应将转化成
 和HSO
和HSO 的物质的量浓度之比是
的物质的量浓度之比是
您最近一年使用:0次
2023-10-01更新
|
401次组卷
|
2卷引用:四川省南充市嘉陵第一中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
8 . 氮元素的各种价态与物质类别的对应关系如图。
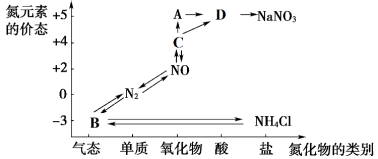
(1)N2的电子式为_______ ,物质A的化学式是_______ 。
(2)若在排气管上安装一种催化转化装置,可使汽车尾气中CO与NOx反应,生成无毒气体,该反应的方程式为_______ 。
(3)实验室中,检验溶液中含有 的实验操作和现象是
的实验操作和现象是_____ 。
(4)写出物质C与水反应的离子方程式_______ ,反应中,每消耗标准状况下3.36 L物质C,转移电子的物质的量为_______ mol。
(5)某同学在实验室中探究一氧化氮能否被Na2O2完全吸收,设计了如下实验,装置如下(加热装置已略去)。已知:2NO+Na2O2=2NaNO2,NO或NO2都能被酸性高锰酸钾氧化为 。
。
①三口烧瓶A中发生反应的化学方程式为_______ 。
②装置B中的作用是_______ 。
③装置C的作用是_______ 。

(1)N2的电子式为
(2)若在排气管上安装一种催化转化装置,可使汽车尾气中CO与NOx反应,生成无毒气体,该反应的方程式为
(3)实验室中,检验溶液中含有
 的实验操作和现象是
的实验操作和现象是(4)写出物质C与水反应的离子方程式
(5)某同学在实验室中探究一氧化氮能否被Na2O2完全吸收,设计了如下实验,装置如下(加热装置已略去)。已知:2NO+Na2O2=2NaNO2,NO或NO2都能被酸性高锰酸钾氧化为
 。
。
①三口烧瓶A中发生反应的化学方程式为
②装置B中的作用是
③装置C的作用是
您最近一年使用:0次
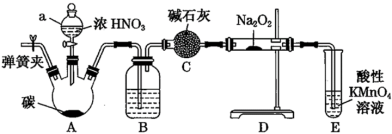
名校
9 . 亚硝酸钠(NaNO2)是一种肉制品生产中常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组设计了如图所示的装置制备NaNO2(A中加热装置已略去,NO可与过氧化钠粉末发生化合反应,也能被酸性KMnO4氧化成 )。
)。
(1)图中装有浓硝酸的仪器的名称是___ 。
(2)A中实验现象为___ 。
(3)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是___ (填字母序号)。
A.烧碱 B.无水CaCl2 C.碱石灰 D.浓硫酸
(4)E中发生反应的离子方程式为___ 。
(5)从提高氮原子利用率的角度出发,其中B装置设计存在一定缺陷,如何改进?___ 。
(6)已知:2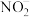 +2I-+4H+=2NO↑+I2+2H2O;2
+2I-+4H+=2NO↑+I2+2H2O;2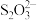 +I2=2I-+
+I2=2I-+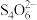 。为测定得到产品中NaNO2的纯度,采取如下实验步骤:准确称取质量为1.00g的NaNO2样品放入锥形瓶中,加适量水溶解后,加入过量的0.800mol·L-1KI溶液、淀粉溶液;然后滴加稀硫酸充分反应后,用0.500mol·L-1Na2S2O3溶液滴定至终点。重复以上操作3次,所消耗Na2S2O3溶液的体积分别为20.02mL、19.98mL、20.25mL。滴定终点时的实验现象为
。为测定得到产品中NaNO2的纯度,采取如下实验步骤:准确称取质量为1.00g的NaNO2样品放入锥形瓶中,加适量水溶解后,加入过量的0.800mol·L-1KI溶液、淀粉溶液;然后滴加稀硫酸充分反应后,用0.500mol·L-1Na2S2O3溶液滴定至终点。重复以上操作3次,所消耗Na2S2O3溶液的体积分别为20.02mL、19.98mL、20.25mL。滴定终点时的实验现象为___ ,该样品中NaNO2纯度为___ 。
 )。
)。
(1)图中装有浓硝酸的仪器的名称是
(2)A中实验现象为
(3)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是
A.烧碱 B.无水CaCl2 C.碱石灰 D.浓硫酸
(4)E中发生反应的离子方程式为
(5)从提高氮原子利用率的角度出发,其中B装置设计存在一定缺陷,如何改进?
(6)已知:2
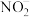 +2I-+4H+=2NO↑+I2+2H2O;2
+2I-+4H+=2NO↑+I2+2H2O;2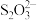 +I2=2I-+
+I2=2I-+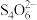 。为测定得到产品中NaNO2的纯度,采取如下实验步骤:准确称取质量为1.00g的NaNO2样品放入锥形瓶中,加适量水溶解后,加入过量的0.800mol·L-1KI溶液、淀粉溶液;然后滴加稀硫酸充分反应后,用0.500mol·L-1Na2S2O3溶液滴定至终点。重复以上操作3次,所消耗Na2S2O3溶液的体积分别为20.02mL、19.98mL、20.25mL。滴定终点时的实验现象为
。为测定得到产品中NaNO2的纯度,采取如下实验步骤:准确称取质量为1.00g的NaNO2样品放入锥形瓶中,加适量水溶解后,加入过量的0.800mol·L-1KI溶液、淀粉溶液;然后滴加稀硫酸充分反应后,用0.500mol·L-1Na2S2O3溶液滴定至终点。重复以上操作3次,所消耗Na2S2O3溶液的体积分别为20.02mL、19.98mL、20.25mL。滴定终点时的实验现象为
您最近一年使用:0次
2020-10-16更新
|
165次组卷
|
2卷引用:江西省新余市第四中学2021届高三上学期第一次段考化学试题
名校
解题方法
10 . 化合价和物质类别是整理元素及其化合物知识的两个要素,可表示为“价—类”二维图。氮元素的“价一类”二维图如图,下列说法正确的是

| A.a与b均可用排空气法收集 |
| B.a可以催化氧化生成b |
| C.c是酸性氧化物 |
| D.铜和d的稀溶液反应,d表现的性质只有氧化性 |
您最近一年使用:0次



