名校
解题方法
1 . 氮气及其重要化合物的转化关系如如图,则下列说法正确的是

| A.路线Ⅰ、Ⅱ、Ⅲ是工业生产硝酸的主要途径 |
| B.反应①②③均需要使用催化剂 |
C.路线Ⅲ的另一种反应物为水时,每1mol 反应,转移电子数目为NA 反应,转移电子数目为NA |
D.已知某条件下 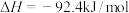 ,该条件下每合成1molNH3放出的热量为46.2kJ ,该条件下每合成1molNH3放出的热量为46.2kJ |
您最近一年使用:0次
2022-10-09更新
|
679次组卷
|
3卷引用:广东省六校2022-2023学年高三上学期第二次联考化学试题
名校
2 . 某兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】亚硝酰氯(NOCl,熔点-64.5℃,沸点-5.5 ℃)是一种黄色气体,液态时呈红褐色,易水解,可用于合成洗涤剂和催化剂等,对眼睛、皮肤和黏膜有强烈刺激性,有毒。冰水中加入NaCl 可降低水的凝固点。
【原料制备】在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充表中各仪器中的试剂。

【合成亚硝酰氯】利用制得的 NO 和 Cl2制备 NOCl,装置如图所示。
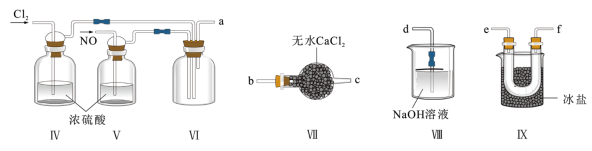
(2)装置连接顺序为 a→____________________ (按气流自左向右方向)。
(3)装置Ⅶ的作用是_________________________ 。
(4)用装置Ⅷ吸收尾气时,NOCl 发生反应的化学方程式为________________ 。
(5)查阅资料,得到配制王水(浓硝酸与浓盐酸按体积比 1∶3 混合而成)时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________________ 。
【查阅资料】亚硝酰氯(NOCl,熔点-64.5℃,沸点-5.5 ℃)是一种黄色气体,液态时呈红褐色,易水解,可用于合成洗涤剂和催化剂等,对眼睛、皮肤和黏膜有强烈刺激性,有毒。冰水中加入NaCl 可降低水的凝固点。
【原料制备】在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充表中各仪器中的试剂。

| 原料制备 | 烧瓶中试剂 | 分液漏斗中试剂 | 装置Ⅱ中试剂 |
| 制备纯净 Cl2 | MnO2 | ① | ② |
| 制备纯净 NO | Cu | ③ | ④ |
【合成亚硝酰氯】利用制得的 NO 和 Cl2制备 NOCl,装置如图所示。

(2)装置连接顺序为 a→
(3)装置Ⅶ的作用是
(4)用装置Ⅷ吸收尾气时,NOCl 发生反应的化学方程式为
(5)查阅资料,得到配制王水(浓硝酸与浓盐酸按体积比 1∶3 混合而成)时会生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
解题方法
3 . 亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,其熔点-64.5°C, 沸点-5.5°C,具有刺鼻恶臭气味,遇水易水解生成HNO2和氯化氢。NOCl 可由NO与纯净的Cl2合成,相关实验装置如图所示(夹持装置略去)。

(1)制备Cl2
①若用高锰酸钾制备Cl2,发生装置可选_______ (填大写字母), 反应的离子方程式为:_______ 。
②欲收集干燥纯净的Cl2,装置接口的连接顺序为a→_______
(2)合成NOCl
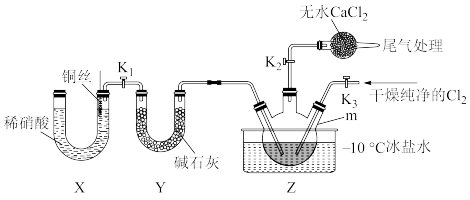
①仪器m的名称为_______ , 写出仪器m中合成NOCl的化学方程式_______ 。
②-10°C冰盐水的作用是_______ 。
③实验中用NaOH溶液进行尾气处理,无水CaCl2的作用是_______ 。
(3)NOCl与水反应生成HNO2与氯化氢。设计实验证明HNO2是弱酸:_______ 。(仅提供:1 mol/L盐酸、1 mol/L HNO2溶液、饱和NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)

(1)制备Cl2
①若用高锰酸钾制备Cl2,发生装置可选
②欲收集干燥纯净的Cl2,装置接口的连接顺序为a→
(2)合成NOCl

①仪器m的名称为
②-10°C冰盐水的作用是
③实验中用NaOH溶液进行尾气处理,无水CaCl2的作用是
(3)NOCl与水反应生成HNO2与氯化氢。设计实验证明HNO2是弱酸:
您最近一年使用:0次
名校
解题方法
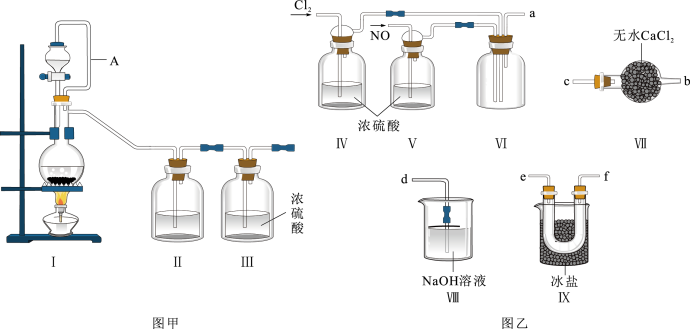
4 . 亚硝酞氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图I、II、III所示:

图中A导管的作用是___________ 为制备纯净干燥的气体,下表中缺少的药品是:
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→_____ (按气流自左向右方向,用小写字母表示)。
②装置IV、V除可进一步干燥NO、Cl2外,另一个作用是______ 。
③装置VII的作用是______________ 。
④装置VIII中吸收尾气时,NOCl发生反应的化学方程式为_________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图I、II、III所示:

图中A导管的作用是
| 装置I | 装置II | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | ① | 浓盐酸 | ② |
| 制备纯净NO | Cu | 稀硝酸 | ③ |

①装置连接顺序为a→
②装置IV、V除可进一步干燥NO、Cl2外,另一个作用是
③装置VII的作用是
④装置VIII中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
5 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示(已知:NO+NO2+2NaOH=2NaNO2+H2O):
(1)用图甲中装置制备纯净干燥的原料气,补充表中所缺少的药品。
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→___ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、V除可进-步干燥NO、Cl2外,另一个作用是___ 。
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置___ 。

(4)装置Ⅷ吸收尾气时,NOCl发生反应的化学方程式为___ 。
(5)有人认为装置Ⅷ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅷ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:___ 。
(6)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.6375g样品溶于50.00mLNaOH溶液中,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.40mol/LAgNO3溶液滴定至产生砖红色沉淀Ag2CrO4,消耗AgNO3溶液50.00mL。(已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2×10-12)
①样品的纯度为___ %(保留三位有效数字)
②若在滴定终点时测得溶液中CrO 的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是
的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是___ 。

(1)用图甲中装置制备纯净干燥的原料气,补充表中所缺少的药品。
| 装置I | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | 浓盐酸 | |
| 制备纯净NO | Cu | 稀硝酸 | 水 |
①装置连接顺序为a→
②装置Ⅳ、V除可进-步干燥NO、Cl2外,另一个作用是
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置

(4)装置Ⅷ吸收尾气时,NOCl发生反应的化学方程式为
(5)有人认为装置Ⅷ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅷ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:
(6)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.6375g样品溶于50.00mLNaOH溶液中,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.40mol/LAgNO3溶液滴定至产生砖红色沉淀Ag2CrO4,消耗AgNO3溶液50.00mL。(已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2×10-12)
①样品的纯度为
②若在滴定终点时测得溶液中CrO
 的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是
的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是
您最近一年使用:0次
名校
6 . Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为_______ (用化学方程式表示,该反应为可逆反应);汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因_______ 。
(2)①NH3去除尾气中NOx的,当V(NO)∶V(NO2)=1∶1时称为“快速SCR反应”,该反应化学方程式为:_______ 。
②合成NH3所用的原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+0.5O2(g)=CO2(g) ∆H1=-282.0 kJ·mol-1
H2(g)+0.5O2(g)=H2O(g) ∆ H 2=-241.8 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆ H 3=-836.3 kJ·mol-1
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:_______ 。
Ⅱ.(1)运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
已知反应:N2(g)+O2(g)⇌2NO(g) ∆ H 1=+180.5 kJ·mol-1
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ∆ H 2
已知CO的燃烧热为283.0 kJ·mol-1,则∆ H 2=_______ 。
(2)氢能源是最具应用前景的能源之一,高纯氢制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接_______ 。产生H2的电极反应式是_______ 。
②改变开关连接方式,可得O2,制O2时,电极3的电极反应式是_______ 。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为
(2)①NH3去除尾气中NOx的,当V(NO)∶V(NO2)=1∶1时称为“快速SCR反应”,该反应化学方程式为:
②合成NH3所用的原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+0.5O2(g)=CO2(g) ∆H1=-282.0 kJ·mol-1
H2(g)+0.5O2(g)=H2O(g) ∆ H 2=-241.8 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆ H 3=-836.3 kJ·mol-1
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:
Ⅱ.(1)运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
已知反应:N2(g)+O2(g)⇌2NO(g) ∆ H 1=+180.5 kJ·mol-1
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ∆ H 2
已知CO的燃烧热为283.0 kJ·mol-1,则∆ H 2=
(2)氢能源是最具应用前景的能源之一,高纯氢制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接
②改变开关连接方式,可得O2,制O2时,电极3的电极反应式是
您最近一年使用:0次
解题方法
7 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:_______ 、________ 。

(2)乙组同学利用甲组制得NO和Cl2制备NOCl,装置如图所示:
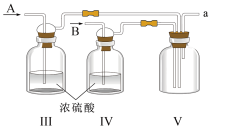

①装置连接顺序为a→________ (按气流自左向右方向,用小写字母表示)。
②为了使气体充分反应,从A处进入的气体是________ (填Cl2或NO)。实验中先通入Cl2,待装置Ⅴ中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是________ (回答一条即可)。
③装置Ⅴ生成NOCl的化学方程式是________ 。
④装置Ⅵ的作用为________ ,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为________ 。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL.亚硝酰氯(NOCl)的质量分数为________ (用代数式表示即可)。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:

装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 反应漏斗中 | ||
| 制备纯净氯气 | 二氧化锰 | ①______ | 饱和食盐水 |
| 制备纯净一氧化氮 | 铜 | 稀硝酸 | ②______ |


①装置连接顺序为a→
②为了使气体充分反应,从A处进入的气体是
③装置Ⅴ生成NOCl的化学方程式是
④装置Ⅵ的作用为
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL.亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次
8 . 亚硝酰氯(NOCl)常用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成亚硝酰氯。
已知:①NOCl是黄色气体,熔点:—64.5℃,沸点:—5.5℃;NOCl遇水易反应生成一种无氧酸和两种氮的常见氧化物;NOCl对眼睛、皮肤和黏膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。
②Ag2CrO4是砖红色沉淀。
实验1:制备原料气NO和Cl2
利用如图1所示装置制备纯净的NO和Cl2。
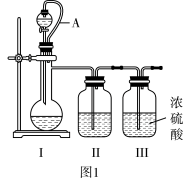
(1)制备纯净的Cl2,烧瓶中反应的化学方程式为___ 。
(2)制备纯净的NO,烧瓶中盛有Cu,装置Ⅱ中盛有___ (填试剂名称);导管A的作用是___ 。
实验2:制备NOCl。
利用实验1中制得的NO和Cl2制备NOCl,装置如图2所示。
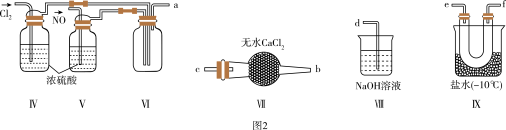
(3)仪器接口的连接顺序为a→___ (按气流从左到右顺序填写)。
(4)装置Ⅳ、Ⅴ除进一步干燥NO和Cl2外,另一作用是____ 。
(5)装置Ⅷ用于吸收尾气,NOCl发生反应的化学方程式为____ 。
实验3:测定NOCl的纯度
将所得亚硝酰氯(NOCl)产品13.5g溶于水,配成250ml该溶液,取出25.00ml该溶液,以K2CrO4溶液为指示剂,用1.0mol/LAgNO3标准溶液滴定至终点,再重复上述实验操作2次,测得三次实验消耗AgNO3标准溶液的平均体积为20.00ml。
(6)达到滴定终点的现象是____ 。
(7)产品中亚硝酰氯(NOCl)的质量分数为___ (保留两位小数)。
已知:①NOCl是黄色气体,熔点:—64.5℃,沸点:—5.5℃;NOCl遇水易反应生成一种无氧酸和两种氮的常见氧化物;NOCl对眼睛、皮肤和黏膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。
②Ag2CrO4是砖红色沉淀。
实验1:制备原料气NO和Cl2
利用如图1所示装置制备纯净的NO和Cl2。

(1)制备纯净的Cl2,烧瓶中反应的化学方程式为
(2)制备纯净的NO,烧瓶中盛有Cu,装置Ⅱ中盛有
实验2:制备NOCl。
利用实验1中制得的NO和Cl2制备NOCl,装置如图2所示。

(3)仪器接口的连接顺序为a→
(4)装置Ⅳ、Ⅴ除进一步干燥NO和Cl2外,另一作用是
(5)装置Ⅷ用于吸收尾气,NOCl发生反应的化学方程式为
实验3:测定NOCl的纯度
将所得亚硝酰氯(NOCl)产品13.5g溶于水,配成250ml该溶液,取出25.00ml该溶液,以K2CrO4溶液为指示剂,用1.0mol/LAgNO3标准溶液滴定至终点,再重复上述实验操作2次,测得三次实验消耗AgNO3标准溶液的平均体积为20.00ml。
(6)达到滴定终点的现象是
(7)产品中亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次
2020-08-21更新
|
443次组卷
|
3卷引用:安徽省六安市第一中学2020届高三适应性考试理科综合化学试题



