1 . 下列说法中正确的是 ( )
| A.加热浓硫酸和乙醇混合液,产生的气体能使溴水褪色 ,证明该气体是乙烯 |
| B.用苯与溴水制取溴苯,溴苯的密度比水的大 |
| C.铜与稀硝酸制取一氧化氮,可以利用排水法收集 |
| D.加热氢氧化钙与氯化铵反应制氨气, 氨气能使红色石蕊试纸变蓝 |
您最近一年使用:0次
2 . 某同学做“FeSO4被HNO3氧化”的实验,发现溶液变深棕色。猜想可能是生成的NO2或NO与Fe2+或Fe3+反应,使溶液变为深棕色,设计下列装置探究。下列说法错误的是
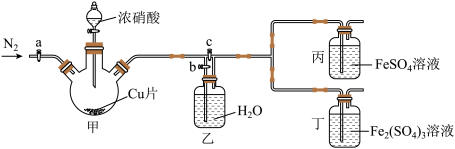

| A.先检查装置气密性,加入药品后,关闭c,打开a和b,再通入一段时间N2 |
| B.关闭a、c,打开b及分液漏斗活塞,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO与Fe2+反应 |
| C.甲中反应一段时间后,更新丙、丁中试剂,关闭a和b,打开c,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO2也可与Fe2+反应 |
| D.该实验的缺陷是缺少尾气吸收装置 |
您最近一年使用:0次
2020-06-22更新
|
724次组卷
|
10卷引用:山东省威海市2020届高三年级高考模拟考(二模)化学试题
山东省威海市2020届高三年级高考模拟考(二模)化学试题浙江省湖州市2020-2021学年高二上学期期末调研测试化学试题(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)河南省洛阳市孟津县第一高级中学2022届高三下学期4月月考化学试题(已下线)第四章 非金属及其化合物 第23练 硝酸 含氮化合物的转化关系山东省济宁市曲阜孔子高级中学2022-2023学年高一下学期4月月考化学试题陕西西北工业大学附属中学2022-2023学年高一下学期期中考试化学试题山东省莱州市第一中学2022-2023学年高二下学期6月月考化学试题甘肃省兰州大学附属中学2022-2023学年高一下学期5月月考(分班考试)化学试题黑龙江省哈尔滨市第九中学校2023-2024学年高一下学期4月学业阶段性评价考试化学试题
3 . 为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是
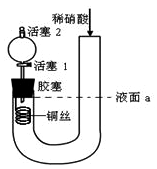

| A.关闭活塞1,加入稀硝酸至液面a处 |
| B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率 |
| C.通过关闭或开启活塞1可以控制反应的进行 |
| D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO |
您最近一年使用:0次
2016-12-09更新
|
1695次组卷
|
19卷引用:2011届北京市丰台区高三下学期统一练习(一)(理综)化学部分
(已下线)2011届北京市丰台区高三下学期统一练习(一)(理综)化学部分2014-2015福建省福州市八县高一下学期联考化学试卷2015-2016学年黑龙江省实验中学高二下期末化学试卷上海市格致中学2016-2017学年高一下学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【押题专练】内蒙古赤峰二中2017-2018学年高一上学期期末考试化学试题(已下线)2018年12月12日 《每日一题》人教必修1-硝酸的强氧化性上海市嘉定区2016届高三第一次质量调研化学试题四川省成都龙泉第二中学2021届高三上学期九月月考化学试题浙江省浙北G2(嘉兴一中、湖州中学)2020-2021学年高二上学期期中联考化学试题辽宁省六校2021届高三上学期期中联考化学试题吉林省延边第二中学2020届高三上学期第一次调研化学试题广东省佛山市顺德李兆基中学2020-2021学年高一3月月考化学试卷江苏省苏州市相城区黄埭中学2020-2021学年高一下学期3月月考化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一4月月考化学试题湖北省部分重点高中2020-2021学年高一下学期4月联考化学试题课中-5.2.3 硝酸 酸雨及防治-人教2019必修第二册江苏省盐城市东台创新高级中学2021-2022学年高一5月份月检测化学试题(已下线)3.2.2 铵盐和硝酸-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)
4 . 下列实验操作能达到实验目的的是
| A.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+ |
| B.用向上排空气法收集铜粉与稀硝酸反应产生的NO |
| C.CCl4萃取碘水中的I2,先从分液漏斗下口放出有机层,后从上口倒出水层 |
| D.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 |
您最近一年使用:0次
5 . 为探究NO与铜粉的反应,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2。
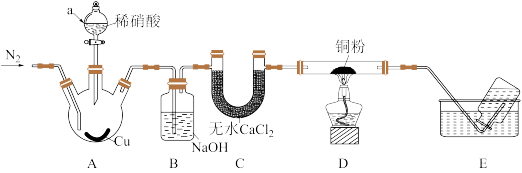
回答下列问题:
(1)通入N2的作用:_____________ ,仪器a的名称_____________ 。
(2)A中发生反应的离子方程式:_____________________________
(3)B中NaOH的作用__________________________ 。
(4)D中有__________________________ 现象,即可证明NO与Cu反应。
(5)NO可被Ce4+氧化,制得NH4NO3产品,流程如下(Ce为铈元素)。
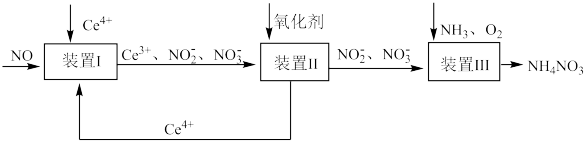
①装置Ⅰ中,酸性条件下NO被Ce4+氧化的产物主要是NO 和NO
和NO ,写出生成等物质的量的NO
,写出生成等物质的量的NO 和NO
和NO 的离子方程式:
的离子方程式:____________________________ 。
②已知进入装置Ⅲ溶液中NO 的浓度为a g·L-1,要使1 m3该溶液中的NO
的浓度为a g·L-1,要使1 m3该溶液中的NO 完全转化为NH4NO3,至少需通入标况下的O2
完全转化为NH4NO3,至少需通入标况下的O2________ L(用含a代数式表示,结果保留整数)。

回答下列问题:
(1)通入N2的作用:
(2)A中发生反应的离子方程式:
(3)B中NaOH的作用
(4)D中有
(5)NO可被Ce4+氧化,制得NH4NO3产品,流程如下(Ce为铈元素)。

①装置Ⅰ中,酸性条件下NO被Ce4+氧化的产物主要是NO
 和NO
和NO ,写出生成等物质的量的NO
,写出生成等物质的量的NO 和NO
和NO 的离子方程式:
的离子方程式:②已知进入装置Ⅲ溶液中NO
 的浓度为a g·L-1,要使1 m3该溶液中的NO
的浓度为a g·L-1,要使1 m3该溶液中的NO 完全转化为NH4NO3,至少需通入标况下的O2
完全转化为NH4NO3,至少需通入标况下的O2
您最近一年使用:0次
2020-10-31更新
|
332次组卷
|
3卷引用:山东省新泰市第一中学老校区(新泰中学)2021届高三上学期第二次月考化学试题
名校
6 . 为探究Cu和一定浓度的 溶液反应所得
溶液反应所得 气体中是否混有NO,某同学设计了如下两个实验方案:
气体中是否混有NO,某同学设计了如下两个实验方案:

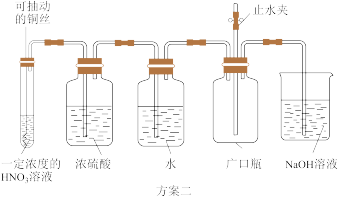
已知: 的沸点为21℃,NO的沸点为-151℃。
的沸点为21℃,NO的沸点为-151℃。
(1)铜和浓硝酸反应的化学方程式为_________________________________ 。
(2)实验中能够让反应立刻停止的操作是_____________________________ 。
(3)指出不能证明反应所得 气体中混有NO的方案并阐述理由:
气体中混有NO的方案并阐述理由:__________________________ 。
(4)反应一段时间后,证明所得 气体中混有NO的实验操作及现象是
气体中混有NO的实验操作及现象是______________________ 。
(5)在催化剂作用下, 可将汽车尾气中的NO还原为空气中的常见物质。写出该反应的化学方程式:
可将汽车尾气中的NO还原为空气中的常见物质。写出该反应的化学方程式:_____________________________ 。
 溶液反应所得
溶液反应所得 气体中是否混有NO,某同学设计了如下两个实验方案:
气体中是否混有NO,某同学设计了如下两个实验方案:

已知:
 的沸点为21℃,NO的沸点为-151℃。
的沸点为21℃,NO的沸点为-151℃。(1)铜和浓硝酸反应的化学方程式为
(2)实验中能够让反应立刻停止的操作是
(3)指出不能证明反应所得
 气体中混有NO的方案并阐述理由:
气体中混有NO的方案并阐述理由:(4)反应一段时间后,证明所得
 气体中混有NO的实验操作及现象是
气体中混有NO的实验操作及现象是(5)在催化剂作用下,
 可将汽车尾气中的NO还原为空气中的常见物质。写出该反应的化学方程式:
可将汽车尾气中的NO还原为空气中的常见物质。写出该反应的化学方程式:
您最近一年使用:0次
2020-09-15更新
|
294次组卷
|
3卷引用:鲁科版(2019)高一必修第一册第三章第3节 氮的循环 课时3 硝酸氮的氧化物对环境的影响
名校
解题方法
7 . 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
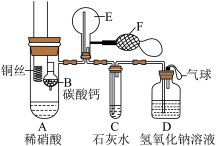
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。检查装置气密性后第一步 实验操作为___ 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为___ 。
(3)如何证明E中收集到的是NO而不是H2__ ,一段时间后,C中白色沉淀溶解,其原因是__ 。
(4)装置D的作用是___ 。

(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。检查装置气密性后
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为
(3)如何证明E中收集到的是NO而不是H2
(4)装置D的作用是
您最近一年使用:0次
2020-09-10更新
|
171次组卷
|
5卷引用:河北省鸡泽县第一中学2021届高三上学期第一次月考化学试题
8 . 亚硝酸钠(NaNO2)易溶于水,微溶于乙醇,可作为肉类食品的护色剂,并可以防止肉毒杆菌在肉类食品中生长,保持肉制品的结构和营养价值;但是过量摄入会导致中毒。某化学兴趣小组对亚硝酸钠进行多角度探究:
I.亚硝酸钠的制备

(1)实验中用恒压滴液漏斗,相比普通分液漏斗,其显著优点是________ 。
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为_______ 。
II.探究亚硝酸钠与硫酸反应生成的气体产物
已知:①NO+NO2+2OH-=2NO +H2O ②气体液化的温度:NO2:21℃,NO:-152℃
+H2O ②气体液化的温度:NO2:21℃,NO:-152℃
(3)反应前应打开弹簧夹,先通入一段时间氮气,其目的是______ 。
(4)为了检验装置A中生成的气体产物,装置的连接顺序(从左→右连接):A、C、______ 、_______ 、______ 。
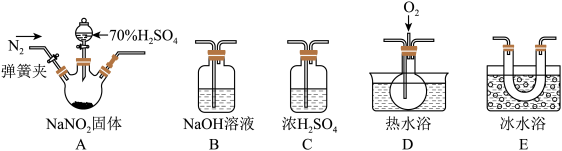
(5)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是_______ 。
②装置E的作用是________ 。
③通过上述实验探究过程,可得出装置A中反应的化学方程式为_______ 。
III.设计实验证明酸性条件下NaNO2具有氧化性
(6)供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液。根据提供的试剂,设计酸性条件下NaNO2具有氧化性的实验方案:_____ 。
I.亚硝酸钠的制备

(1)实验中用恒压滴液漏斗,相比普通分液漏斗,其显著优点是
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为
II.探究亚硝酸钠与硫酸反应生成的气体产物
已知:①NO+NO2+2OH-=2NO
 +H2O ②气体液化的温度:NO2:21℃,NO:-152℃
+H2O ②气体液化的温度:NO2:21℃,NO:-152℃(3)反应前应打开弹簧夹,先通入一段时间氮气,其目的是
(4)为了检验装置A中生成的气体产物,装置的连接顺序(从左→右连接):A、C、

(5)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是
②装置E的作用是
③通过上述实验探究过程,可得出装置A中反应的化学方程式为
III.设计实验证明酸性条件下NaNO2具有氧化性
(6)供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液。根据提供的试剂,设计酸性条件下NaNO2具有氧化性的实验方案:
您最近一年使用:0次
2020-11-20更新
|
578次组卷
|
2卷引用:山西省太原市2021届高三上学期期中考试化学试题
19-20高二·浙江·期中
解题方法
9 . 硝酸是重要的化工原料,工业上将产生的NO2、NO、O2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)写出用上述方法将NO2完全生成HNO3的化学反应方程式_______ 。
(2)工业上用氨作原料制硝酸,用氨和硝酸制得硝酸铵。若由氨催化氧化制得一氧化氮的产率为96%,由NO制得硝酸的转化率为92%,氨和硝酸制硝酸铵时100%利用。则生产0.2t硝酸铵需要_______ m3(标准状况)的氨气。
(3)为了证明NO可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
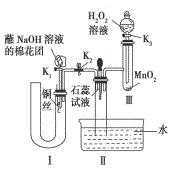
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至U形管右侧胶塞下沿后,迅速关闭K1,观察到U形管内的现象是_______ 。
②装置II中发生反应的化学方程式为_______ 。
③蘸有NaOH溶液的棉花团的作用是_______ 。
④打开K2,至装置II中长玻璃管中的气体呈无色后,打开K3,反应一段时间后关闭K3,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否食NO:_______ 。
(1)写出用上述方法将NO2完全生成HNO3的化学反应方程式
(2)工业上用氨作原料制硝酸,用氨和硝酸制得硝酸铵。若由氨催化氧化制得一氧化氮的产率为96%,由NO制得硝酸的转化率为92%,氨和硝酸制硝酸铵时100%利用。则生产0.2t硝酸铵需要
(3)为了证明NO可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。

①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至U形管右侧胶塞下沿后,迅速关闭K1,观察到U形管内的现象是
②装置II中发生反应的化学方程式为
③蘸有NaOH溶液的棉花团的作用是
④打开K2,至装置II中长玻璃管中的气体呈无色后,打开K3,反应一段时间后关闭K3,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否食NO:
您最近一年使用:0次
解题方法
10 . 两组同学分别通过实验验证氮和硫的氧化物性质。
Ⅰ.甲组同学用图示装置制备一氧化氮并验证其还原性。
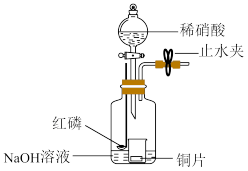
(1)铜与稀硝酸反应的离子方程式是__________ 。
(2)滴入稀硝酸前,先关闭止水夹,点燃红磷并伸入瓶中,塞好胶塞。这样操作的目的是__________ 。
(3)滴入稀硝酸后,烧杯中的现象是__________ 。
(4)烧杯中的反应停止后,打开止水夹,通入__________ 可验证 NO 的还原性。
Ⅱ.乙组同学为了探究二氧化硫的性质,将二氧化硫分别通入下列三种溶液中。

(5)试管 a 中观察到的现象是__________ 。
(6)试管 b 中观察到紫色褪去,能证明 SO2具有的性质是__________ 。
(7)试管 c 中产生白色沉淀,该白色沉淀是__________ (填化学式)。
Ⅰ.甲组同学用图示装置制备一氧化氮并验证其还原性。

(1)铜与稀硝酸反应的离子方程式是
(2)滴入稀硝酸前,先关闭止水夹,点燃红磷并伸入瓶中,塞好胶塞。这样操作的目的是
(3)滴入稀硝酸后,烧杯中的现象是
(4)烧杯中的反应停止后,打开止水夹,通入
Ⅱ.乙组同学为了探究二氧化硫的性质,将二氧化硫分别通入下列三种溶液中。

(5)试管 a 中观察到的现象是
(6)试管 b 中观察到紫色褪去,能证明 SO2具有的性质是
(7)试管 c 中产生白色沉淀,该白色沉淀是
您最近一年使用:0次



