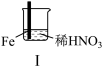
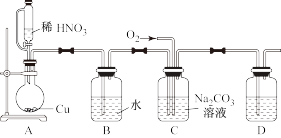
1 . 如图所示(a中活塞的质量与筒壁的摩擦力不计;与K相连的细管的体积也忽略不计)。在标准状况下:
(1)b中气体与水不接触,打开K足够长时间后,a中气体体积减少(ΔV)的范围是:_______ 。
(2)在上述(1)之后,快速推a中活塞至a中气体全部进入b中,观察到的现象是_______ ,原因是_______ 。
(3)若固定a中活塞如图所示,打开K,移走b的密封套,足够长时间后,观察到液面上升,其中涉及的化学反应方程式为_______ 。

(1)b中气体与水不接触,打开K足够长时间后,a中气体体积减少(ΔV)的范围是:
(2)在上述(1)之后,快速推a中活塞至a中气体全部进入b中,观察到的现象是
(3)若固定a中活塞如图所示,打开K,移走b的密封套,足够长时间后,观察到液面上升,其中涉及的化学反应方程式为
您最近一年使用:0次
名校
解题方法
2 . 亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠进行多角度探究:
I.亚硝酸钠的制备
(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是___________ 。
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为___________ 。
II.探究亚硝酸钠与硫酸反应气体产物成分。
已知:①NO+NO2+2OH-═2 +H2O②气体液化的温度:NO2:21℃,NO:-152℃
+H2O②气体液化的温度:NO2:21℃,NO:-152℃

(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是___________ 。
(4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A→C→_____ →_____ →_____ 。
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是___________ 。
②装置B的作用是___________ 。
I.亚硝酸钠的制备

(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为
II.探究亚硝酸钠与硫酸反应气体产物成分。
已知:①NO+NO2+2OH-═2
 +H2O②气体液化的温度:NO2:21℃,NO:-152℃
+H2O②气体液化的温度:NO2:21℃,NO:-152℃
(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是
(4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A→C→
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是
②装置B的作用是
您最近一年使用:0次
名校
解题方法
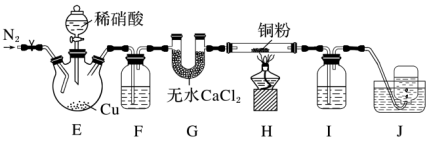
3 . 某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。 [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法中不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法中不正确的是
 [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法中不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法中不正确的是| A.装置F、I中的试剂依次为水、硫酸亚铁溶液 |
| B.若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应 |
| C.实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞 |
| D.装置J收集的气体中一定不含NO |
您最近一年使用:0次
2021-08-09更新
|
1422次组卷
|
24卷引用:福建省三明市第一中学2022届高三10月月考化学试题
福建省三明市第一中学2022届高三10月月考化学试题(已下线)第14讲 氮及其化合物(精讲)-2022年一轮复习讲练测(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省大庆实验中学2022届高三10月月考化学试题2021年北京高考化学试题变式题1-10福建省德化第一中学2024-2024学年高一下学期第一次月考化学试题江西名校学术联盟(临川一中、景德镇一中、雁潭一中等)2018届高三教学质量检测考试(二)理综-化学试题(已下线)黄金30题系列 高一化学 小题好拿分【提升版】(已下线)2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(理综)(B卷)江西省抚州市临川区第一中学2018届高三上学期教学质量检测(二)理科化学试题四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.15 物质的制备及实验方案设计与评价江西省2018届高三六校联考理科综合化学试题【全国百强校】广西陆川县中学2018届高三下学期第二次质量检测理科综合化学试题(已下线)2018年5月27日 每周一测——《每日一题》2018年高三化学四轮复习辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题【全国百强校】四川省棠湖中学2019届高三上学期期末考试理综-化学试题(已下线)2019年5月26日 《每日一题》四轮复习——每周一测020届高三化学实验复习——仪器连接、实验操作顺序【选择突破】浙江省富阳中学2020-2021学年高二上学期第一次月考化学试题(已下线)【浙江新东方】42.(已下线)专题25 化学实验综合性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
4 . 自然界中氮的部分循环过程如下图,有关说法正确的是
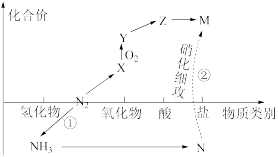

| A.过程①和过程②均属于自然固氮 |
| B.X转化为Y的反应原子利用率为100% |
C.N转为为 或M均发生氧化还原反应 或M均发生氧化还原反应 |
| D.若为硫循环,X在空气中点燃可得Y |
您最近一年使用:0次
2021-08-04更新
|
755次组卷
|
6卷引用:福建省三明市第一中学2022届高三10月月考化学试题
福建省三明市第一中学2022届高三10月月考化学试题广东省2022届高三8月阶段性质量检测化学试题广东省深圳外国语学校2021-2022学年下学期高三第二次检测考试化学试题(已下线)押广东卷化学第10题 元素及其化合物-备战2022年高考化学临考题号押题(广东卷)湖南省株洲市攸县第一中学2022届高三下学期四月月考化学试题(已下线)3.3.2 氮循环-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)
解题方法
5 . 亚硝酸盐是一种重要化工原料,也广泛存在于自然环境中,如蔬菜、肉类、豆类等都可以测出一定量的亚硝酸盐。
某研究性学习小组模拟工业利用烧碱溶液处理氮氧化物尾气的反应,进行亚硝酸钠的制备:实验装置如图所示,用烧碱溶液充分吸收所得中和液经相关分离操作,可将亚硝酸钠与硝酸钠分离,即制得亚硝酸钠成品。
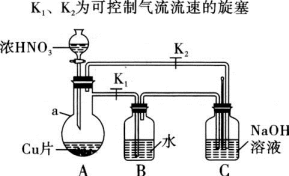
(1)仪器a的名称为___________ 。
(2)写出B装置中发生反应的化学方程式:___________ 。
(3)C装置除了混合NO与NO2的作用,还具有的两个作用,写出其中一个作用___________
(4)已知溶解度数据:10℃亚硝酸钠75.1g,硝酸钠80g;80℃亚硝酸钠113g,硝酸钠150g.可通过蒸发结晶,___________ (操作名称)将两者分离,得到亚硝酸钠粗品。
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有___________ 。
A.自来水 B.碘化钾淀粉试液 C.淀粉 D.白糖 E.食醋 F.白酒
(6)充分反应后,某同学设计实验对C中NaNO2的含量进行检测。称取C中固体2g,完全溶解配制成溶液100mL,取出25mL溶液与0.100mol/L酸性KMnO4溶液进行反应(已知酸性条件下:NO +MnO
+MnO +H+—NO
+H+—NO +Mn2++H2O(未配平),杂质不与KMnO4反应),达到终点消耗KMnO4溶液20mL,求样品中亚硝酸钠的质量分数(只列式,不用化简,不用计算,已知:NaNO2摩尔质量69g/mol)
+Mn2++H2O(未配平),杂质不与KMnO4反应),达到终点消耗KMnO4溶液20mL,求样品中亚硝酸钠的质量分数(只列式,不用化简,不用计算,已知:NaNO2摩尔质量69g/mol)___________ 。
某研究性学习小组模拟工业利用烧碱溶液处理氮氧化物尾气的反应,进行亚硝酸钠的制备:实验装置如图所示,用烧碱溶液充分吸收所得中和液经相关分离操作,可将亚硝酸钠与硝酸钠分离,即制得亚硝酸钠成品。

(1)仪器a的名称为
(2)写出B装置中发生反应的化学方程式:
(3)C装置除了混合NO与NO2的作用,还具有的两个作用,写出其中一个作用
(4)已知溶解度数据:10℃亚硝酸钠75.1g,硝酸钠80g;80℃亚硝酸钠113g,硝酸钠150g.可通过蒸发结晶,
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有
A.自来水 B.碘化钾淀粉试液 C.淀粉 D.白糖 E.食醋 F.白酒
(6)充分反应后,某同学设计实验对C中NaNO2的含量进行检测。称取C中固体2g,完全溶解配制成溶液100mL,取出25mL溶液与0.100mol/L酸性KMnO4溶液进行反应(已知酸性条件下:NO
 +MnO
+MnO +H+—NO
+H+—NO +Mn2++H2O(未配平),杂质不与KMnO4反应),达到终点消耗KMnO4溶液20mL,求样品中亚硝酸钠的质量分数(只列式,不用化简,不用计算,已知:NaNO2摩尔质量69g/mol)
+Mn2++H2O(未配平),杂质不与KMnO4反应),达到终点消耗KMnO4溶液20mL,求样品中亚硝酸钠的质量分数(只列式,不用化简,不用计算,已知:NaNO2摩尔质量69g/mol)
您最近一年使用:0次
6 . 研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价一物质类别关系如图,以下说法正确的是
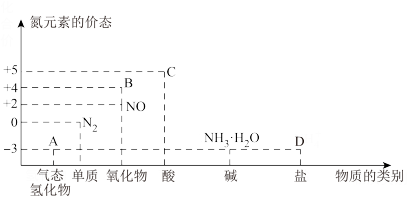

| A.物质A转化为NO需要加入氧化剂 |
| B.标准状况下,3.36L物质B与水完全反应,电子转移0.2mol |
C.物质C的浓溶液与Cu反应的离子方程式为3Cu+8H++2 =3Cu2++2NO↑+4H2O =3Cu2++2NO↑+4H2O |
| D.D中阳离子的检验方法是取少量溶液于试管中,加热,生成气体能使湿润的红色石蕊试纸变蓝 |
您最近一年使用:0次
2021-07-15更新
|
315次组卷
|
2卷引用:福建省仙游第一中学2020-2021学年高一下学期期末考试化学试题
7 . 下列实验装置能达到实验目的的是
A.制备并收集 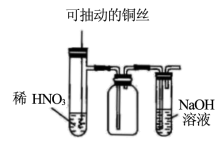 |
B.进行“喷泉”实验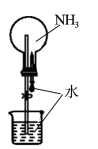 |
C.检验乙醇中是否有水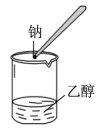 |
D. 尾气吸收 尾气吸收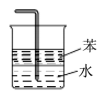 |
您最近一年使用:0次
2021-07-14更新
|
169次组卷
|
2卷引用:福建省漳州市2020-2021学年高一下学期期末高中教学质量检测化学试题
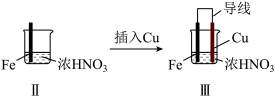
8 . 某学习小组探究某浓度浓硝酸和稀硝酸与铁的反应。
(1)Ⅰ中液面上方气体由无色变为红棕色的化学方程式为_______ 。
(2)取少量Ⅰ中溶液,加入_______ (填名称),溶液变成红色,说明产生了Fe3+。
(3)Ⅱ中现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应。说明硝酸具有_______ 性。
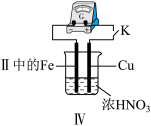
(4)Ⅲ中,连接导线后体系形成了原电池。为分析反应过程,在Fe、Cu之间连接电流计,实验如表。
①推测现象ⅰ中被还原的是_______ 。
②若将该装置Cu电极换成Zn电极,实验过程中是否会出现现象ii_______ (填“是”、“否”) 。
③现象ⅲ中,Fe一直做负极,难以形成氧化层,可能的原因是_______ 。
④用方程式解释现象ⅳ:_______ 。
| 实验 |
|
| |
| 现象 | Ⅰ中:Fe表面产生大量无色气泡,液面上方变为红棕色 | Ⅱ中:Fe表面产生红棕色气泡,过一会儿停止 | Ⅲ中:连接导线,一段时间后Fe表面产生红棕色气泡,而后停止;随即又产生红棕色气泡,而后停止,……如此往复多次。Cu表面始终产生红棕色气泡 |
(2)取少量Ⅰ中溶液,加入
(3)Ⅱ中现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应。说明硝酸具有
(4)Ⅲ中,连接导线后体系形成了原电池。为分析反应过程,在Fe、Cu之间连接电流计,实验如表。
| 实验 | 现象 |
| ⅰ.K闭合时,指针向左偏转(Cu做负极),Fe表面无明显现象 ⅱ.过一会儿指针向右偏,Fe表面产生红棕色气体;后又迅速向左偏,Fe表面停止产生气泡,……如此往复多次 ⅲ.一段时间后,指针一直处于右端,Fe表面持续产生红棕色气体 ⅳ.Cu表面始终产生红棕色气泡 |
②若将该装置Cu电极换成Zn电极,实验过程中是否会出现现象ii
③现象ⅲ中,Fe一直做负极,难以形成氧化层,可能的原因是
④用方程式解释现象ⅳ:
您最近一年使用:0次
2021-05-27更新
|
950次组卷
|
2卷引用:福建省福州一中2021届高三第五次模拟考试化学试题
解题方法
9 . (1)从下列各组物质中,找出合适的序号填在对应的空格内:
①1H2O和2H2O ②12C和14C ③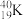 和
和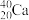 ④甲烷和丙烷 ⑤异戊烷(
④甲烷和丙烷 ⑤异戊烷(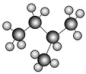 )和新戊烷(
)和新戊烷(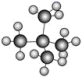 ) ⑥
) ⑥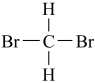 和
和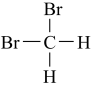
互为同位素的是____ (填序号,下同)。互为同分异构体的是____ 。互为同系物的是___ 。
(2)下图是氮气及几种氮的化合物间的转换关系。请回答下列问题:
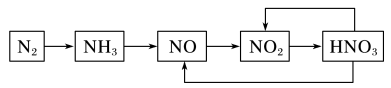
①工业上常用NH3制取NO,请写出反应的化学方程式___________ 。
②生产硝酸时排放的NO会污染环境,一种治理方案是用氨气在催化剂作用下将NO还原成N2,请配平化学方程式:____ _____NH3+_____NO  _____N2+_____H2O
_____N2+_____H2O
③有一瓶稀硫酸和稀硝酸的混合溶液,其中c(H2SO4)=2.0 mol•L-1,c(HNO3=1.0 mol•L-1取100mL该混合溶液与12.8g铜粉反应,标准状况下生成NO的体积为___________ L。
①1H2O和2H2O ②12C和14C ③
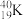 和
和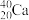 ④甲烷和丙烷 ⑤异戊烷(
④甲烷和丙烷 ⑤异戊烷( )和新戊烷(
)和新戊烷( ) ⑥
) ⑥ 和
和
互为同位素的是
(2)下图是氮气及几种氮的化合物间的转换关系。请回答下列问题:

①工业上常用NH3制取NO,请写出反应的化学方程式
②生产硝酸时排放的NO会污染环境,一种治理方案是用氨气在催化剂作用下将NO还原成N2,请配平化学方程式:
 _____N2+_____H2O
_____N2+_____H2O③有一瓶稀硫酸和稀硝酸的混合溶液,其中c(H2SO4)=2.0 mol•L-1,c(HNO3=1.0 mol•L-1取100mL该混合溶液与12.8g铜粉反应,标准状况下生成NO的体积为
您最近一年使用:0次
名校
解题方法
10 . 绿水青山是习近平总书记构建美丽中国的伟大构想,某工厂拟综合处理含 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程:
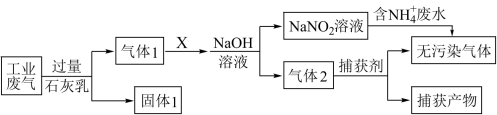
下列说法不正确的是
 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程:
下列说法不正确的是
| A.固体1中主要含有CaCO3、CaSO3、Ca(OH)2 |
| B.X可以是空气,但不能过量 |
| C.捕获剂所捕获的气体主要是CO、N2 |
D.处理含 废水时,发生的反应为: 废水时,发生的反应为: + + =N2↑+2H2O =N2↑+2H2O |
您最近一年使用:0次
2021-04-17更新
|
985次组卷
|
14卷引用:福建省泉州科技中学2020-2021学年高一下学期期中考试化学试题
福建省泉州科技中学2020-2021学年高一下学期期中考试化学试题福建省漳州市2020-2021学年高一下学期期末高中教学质量检测化学试题江苏省锡山高级中学2020-2021学年高一下学期期中考试(基础班)化学试题河北沧州泊头一中2020-2021学年高一下学期第二次月考化学试卷江西省抚州市黎川县第一中学2020-2021学年高一下学期期末质量检测化学试题江苏省海州高级中学2021-2022学年高一下学期期中考试化学试题广东省潮州市2022届高三下学期第二次模拟考试化学试题江苏省常州市北郊高级中学2022-2023学年高一下学期3月调研化学试题四川省成都市树德中学2022-2023学年高一下学期4月月考化学试题 (已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)四川省眉山市仁寿县2022-2023学年高一下学期5月期中联考化学试题江苏省徐州市铜山区2022-2023学年高一下学期期中化学(选择考)试题江苏省苏州市第三中学校2022-2023学年高一下学期5月份月考化学试题(已下线)第5讲 氮及其化合物