1 . 如下图所示,某同学利用Na2SO3和浓H2SO4制取SO2并探究其性质。

(1)写出装置B中发生反应的离子方程式:___________ 。
(2)装置C中的实验现象是___________ ,该实验现象说明SO2具有___________ 性。
(3)能验证SO2具有酸性氧化物的通性的实验现象是___________ 。
(4)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象:___________ 。
(5)探究H2SO3的酸性强于HClO,该同学用如下图所示装置达成实验目的。
A.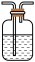 小苏打溶液B.
小苏打溶液B.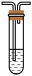 品红溶液C.
品红溶液C.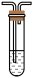 酸性KMnO4溶液D.
酸性KMnO4溶液D.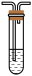 漂白粉溶液
漂白粉溶液
装置的连接顺序为纯净SO2→___________ (选填字母); D中反应的离子方程式为___________ 。

(1)写出装置B中发生反应的离子方程式:
(2)装置C中的实验现象是
(3)能验证SO2具有酸性氧化物的通性的实验现象是
(4)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象:
(5)探究H2SO3的酸性强于HClO,该同学用如下图所示装置达成实验目的。
A.
 小苏打溶液B.
小苏打溶液B. 品红溶液C.
品红溶液C. 酸性KMnO4溶液D.
酸性KMnO4溶液D. 漂白粉溶液
漂白粉溶液装置的连接顺序为纯净SO2→
您最近一年使用:0次
名校
解题方法
2 . 近年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤。
【实验目的】通过实验证明煤中含有碳元素和硫元素。
(1)查阅资料知,二氧化硫能使高锰酸钾溶液褪色。请完成该反应的离子方程式:
____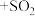 ____
____ _____=_____
_____=_____ _____
_____ ____
____ 。
。____________
(2)根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
【实验操作】甲同学进行了如图所示A、B两步实验。
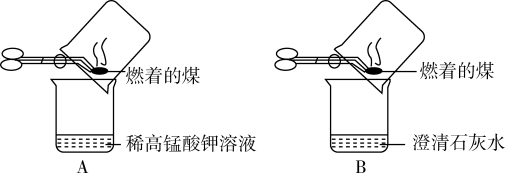
【实验现象】A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
【得出结论】煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
①乙同学认为甲同学的方案不合理,其理由是_____________________ 。
【实验操作】丙同学进行了如图所示实验。
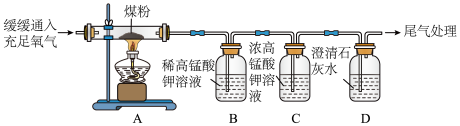
②C装置的作用是_____________________ 。
③证明煤中含有碳元素和硫元素的现象是_______________________ 。
④C装置中的浓高锰酸钾溶液也可以替换为_______________ (填标号)。
A.足量I2的淀粉溶液B.足量饱和 溶液
溶液
C.足量 溶液D.足量溴水
溶液D.足量溴水
【实验目的】通过实验证明煤中含有碳元素和硫元素。
(1)查阅资料知,二氧化硫能使高锰酸钾溶液褪色。请完成该反应的离子方程式:
____
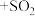 ____
____ _____=_____
_____=_____ _____
_____ ____
____ 。
。(2)根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
【实验操作】甲同学进行了如图所示A、B两步实验。

【实验现象】A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
【得出结论】煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
①乙同学认为甲同学的方案不合理,其理由是
【实验操作】丙同学进行了如图所示实验。

②C装置的作用是
③证明煤中含有碳元素和硫元素的现象是
④C装置中的浓高锰酸钾溶液也可以替换为
A.足量I2的淀粉溶液B.足量饱和
 溶液
溶液C.足量
 溶液D.足量溴水
溶液D.足量溴水
您最近一年使用:0次
2020-10-10更新
|
405次组卷
|
6卷引用:高一必修第一册(苏教2019) 核心素养解读
解题方法
3 . 下列实验装置不能达到实验目的的是( )
实验室用装置甲制备氨气
实验室用装置甲制备氨气
 | 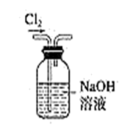 | 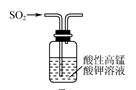 |  |
甲 | 乙 | 丙 | 丁 |
| A.实验室用装置甲制备氨气 |
| B.用装置乙除去Cl2中混有的少量HCl |
| C.用装置丙验证SO2的还原性 |
| D.用装置丁制取Fe(OH)2 |
您最近一年使用:0次
2020-09-02更新
|
212次组卷
|
2卷引用:9.2.2反应条件影响的探究(课后)-2019苏教版必修2课前课中课后
4 . I.利用下图装置制备 ,并研究
,并研究 的性质。
的性质。
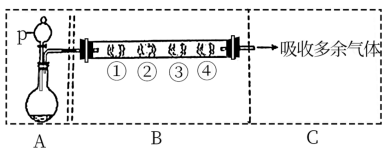
(1)A装置利用亚硫酸钠和硫酸反应制备 ,写出化学方程式
,写出化学方程式_______ 。
(2)填写下表
(3) 和氯气按照体积比
和氯气按照体积比 通入水中,溶液的漂白性
通入水中,溶液的漂白性_______ (填“增强”“减弱”“不变”)原因是_______ (用化学方程式表示)。
II.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
,得到亚硫酸钠(Na2SO3)粗品。其流程如下:

(4)上述流程中,加入 后,发生反应的化学方程式为
后,发生反应的化学方程式为_______ 。
(5)亚硫酸钠粗品中含有少量 ,原因是
,原因是_______ 。
 ,并研究
,并研究 的性质。
的性质。
(1)A装置利用亚硫酸钠和硫酸反应制备
 ,写出化学方程式
,写出化学方程式(2)填写下表
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 褪色 | 浅黄色 | ||
体现 的性质 的性质 |
(3)
 和氯气按照体积比
和氯气按照体积比 通入水中,溶液的漂白性
通入水中,溶液的漂白性II.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
(4)上述流程中,加入
 后,发生反应的化学方程式为
后,发生反应的化学方程式为(5)亚硫酸钠粗品中含有少量
 ,原因是
,原因是
您最近一年使用:0次
名校
5 . 如图是实验室制备SO2并验证SO2某些性质的装置图。试回答:
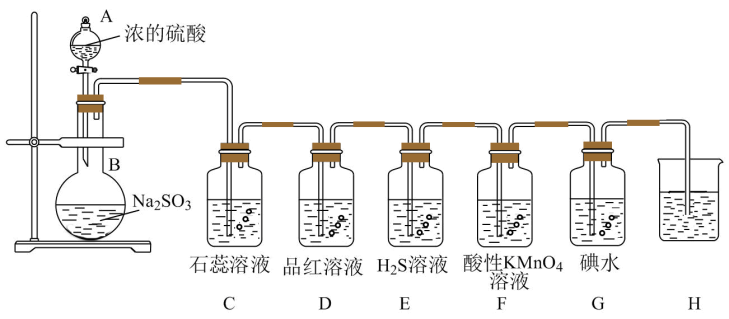
(1)写出仪器A的名称___ ,写出此实验中制备SO2化学方程式___ 。
(2)C中的现象是___ ,此实验证明SO2是___ 气体。
(3)D中的反应现象证明SO2有___ 性;F中的现象是___ ,G中SO2与碘水反应的方程式:___ 。
(4)H中的试剂是氢氧化钠溶液,用于吸收多余的二氧化硫气体,防止污染空气;反应的离子方程式为___ 。

(1)写出仪器A的名称
(2)C中的现象是
(3)D中的反应现象证明SO2有
(4)H中的试剂是氢氧化钠溶液,用于吸收多余的二氧化硫气体,防止污染空气;反应的离子方程式为
您最近一年使用:0次
2020-04-28更新
|
1131次组卷
|
3卷引用:人教版2019必修第二册 第五章 第一节 第1课时 硫和二氧化硫
人教版2019必修第二册 第五章 第一节 第1课时 硫和二氧化硫四川省遂宁市第二中学校2017-2018学年高一下学期期中考试化学试题(已下线)第01讲 硫、二氧化硫-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
名校
解题方法
6 . 工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4 Fe2O3+SO2↑+SO3↑。为检验FeSO4高温分解的产物,进行如下实验:
Fe2O3+SO2↑+SO3↑。为检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入如图所示的装置中,以检验产生的气体中是否含有SO2、SO3。
请回答下列问题:

(1)写出KSCN溶液与Fe3+反应的离子方程式:____ 。
(2)操作②中观察到的现象和结论是____ ;_____ 。
(3)操作②中最后要将通过品红溶液的气体通入NaOH溶液中的原因是___ ,有关反应的离子方程式____ 。
 Fe2O3+SO2↑+SO3↑。为检验FeSO4高温分解的产物,进行如下实验:
Fe2O3+SO2↑+SO3↑。为检验FeSO4高温分解的产物,进行如下实验:①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入如图所示的装置中,以检验产生的气体中是否含有SO2、SO3。
请回答下列问题:

(1)写出KSCN溶液与Fe3+反应的离子方程式:
(2)操作②中观察到的现象和结论是
(3)操作②中最后要将通过品红溶液的气体通入NaOH溶液中的原因是
您最近一年使用:0次
名校
7 . 某化学实验小组的同学为探究和比较 和氯水的漂白性,设计了如图所示的实验装置:
和氯水的漂白性,设计了如图所示的实验装置:

(1)实验室用装置 制备
制备 。某同学在实验时发现打开
。某同学在实验时发现打开 的分液漏斗活塞后,漏斗中的液体未流下,你认为原因可能是
的分液漏斗活塞后,漏斗中的液体未流下,你认为原因可能是____________ 。
(2)装置 中所用的试剂是亚硫酸钠固体和浓硫酸,写出烧瓶中发生反应的化学方程式:
中所用的试剂是亚硫酸钠固体和浓硫酸,写出烧瓶中发生反应的化学方程式:____________ 。
(3)①反应开始一段时间后,观察到 、
、 两个试管中的品红溶液出现的现象分别为:
两个试管中的品红溶液出现的现象分别为:
______ ,
______ 。
②停止通气后,再对 、
、 两个试管分别加热,两个试管中的现象分别为:
两个试管分别加热,两个试管中的现象分别为:
______ ,
______ 。
(4)装置 的作用是
的作用是______ ,写出其中发生反应的离子方程式:____________ 。
 和氯水的漂白性,设计了如图所示的实验装置:
和氯水的漂白性,设计了如图所示的实验装置:
(1)实验室用装置
 制备
制备 。某同学在实验时发现打开
。某同学在实验时发现打开 的分液漏斗活塞后,漏斗中的液体未流下,你认为原因可能是
的分液漏斗活塞后,漏斗中的液体未流下,你认为原因可能是(2)装置
 中所用的试剂是亚硫酸钠固体和浓硫酸,写出烧瓶中发生反应的化学方程式:
中所用的试剂是亚硫酸钠固体和浓硫酸,写出烧瓶中发生反应的化学方程式:(3)①反应开始一段时间后,观察到
 、
、 两个试管中的品红溶液出现的现象分别为:
两个试管中的品红溶液出现的现象分别为:

②停止通气后,再对
 、
、 两个试管分别加热,两个试管中的现象分别为:
两个试管分别加热,两个试管中的现象分别为:

(4)装置
 的作用是
的作用是
您最近一年使用:0次
2020-03-04更新
|
886次组卷
|
3卷引用:必修第二册RJ第5章第一节易错疑难集训(一)
8 . 某实验小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:

(1)仪器a的名称是____ 。
(2)利用图中A装置进行实验室制备SO2的化学方程式是____ 。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色。停止通气后,给B、D两支试管中的液体加热,试管中现象是:B__ ;D___ 。据此,说明SO2的漂白特点是_____ 。
(4)装置C的作用是_______ 。
(5)将等物质的量的SO2和Cl2同时通入水中,所得水溶液没有漂白性的原因是(用离子方程式表示)________ 。要检验此时溶液中生成的负一价阴离子,方法是_____ (要求答出具体实验操作、现象及结论)。

(1)仪器a的名称是
(2)利用图中A装置进行实验室制备SO2的化学方程式是
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色。停止通气后,给B、D两支试管中的液体加热,试管中现象是:B
(4)装置C的作用是
(5)将等物质的量的SO2和Cl2同时通入水中,所得水溶液没有漂白性的原因是(用离子方程式表示)
您最近一年使用:0次
2019-06-01更新
|
336次组卷
|
3卷引用:苏教版(2020)高一必修第一册专题4第一单元课时1 硫、二氧化硫和三氧化硫
13-14高三上·江西·阶段练习
9 . 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。探究二氧化硫的制取和性质都有着非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O2 2Fe2O3+8SO2。该反应中被氧化的元素是
2Fe2O3+8SO2。该反应中被氧化的元素是______ (填元素符号)。当该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为______ L。
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,下图中可选用的发生装置是______ (填写字母)。
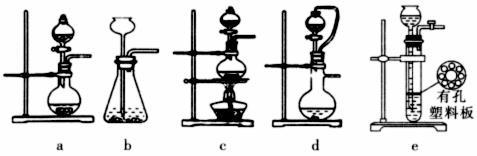
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有25.2%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠______ g(保留一位小数)。
(3)某化学兴趣小组设计用如图装置验证二氧化硫的化学性质。

①能说明二氧化硫具有氧化性的实验现象为______ 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成
上述方案中合理的是______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为______ 。
(1)工业上用黄铁矿(FeS2,其中S元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O2
 2Fe2O3+8SO2。该反应中被氧化的元素是
2Fe2O3+8SO2。该反应中被氧化的元素是(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,下图中可选用的发生装置是

②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有25.2%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠
(3)某化学兴趣小组设计用如图装置验证二氧化硫的化学性质。

①能说明二氧化硫具有氧化性的实验现象为
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成
上述方案中合理的是
您最近一年使用:0次
10 . 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_________________________________________ 。
(2)实验室用装置E制备Cl2,其反应化学化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①指出该反应中在反应中HCl(浓)所表现出的化学性质_____________ 、___________ 。
②请把(2)中的化学方程式改写为离子方程式_______________________________________ 。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________ 的现象(填选项,下同。
A.品红都褪色 B.品红都不褪色
C.试管B 中品红褪色D 中不褪色 D.试管D 中品红褪色B 中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为__________ 。
A.无色 红色 B.无色 无色 C.红色 红色 D.红色 无色
(4)C 烧杯氢氧化钠溶液的作用是________________________ 。
(5)另一个实验小组的同学认为SO2 和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________________________ 。

(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:
(2)实验室用装置E制备Cl2,其反应化学化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O①指出该反应中在反应中HCl(浓)所表现出的化学性质
②请把(2)中的化学方程式改写为离子方程式
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现
A.品红都褪色 B.品红都不褪色
C.试管B 中品红褪色D 中不褪色 D.试管D 中品红褪色B 中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为
A.无色 红色 B.无色 无色 C.红色 红色 D.红色 无色
(4)C 烧杯氢氧化钠溶液的作用是
(5)另一个实验小组的同学认为SO2 和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
您最近一年使用:0次
2018-03-07更新
|
772次组卷
|
3卷引用:高一必修第二册(人教2019版)第五章 第一节 硫及其化合物 课时1 硫和二氧化硫



