1 . 非金属单质A经如图所示的过程可转化为含氧酸D,已知D为强酸。请回答下列问题。

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是_______ 。
②在工业生产中,B气体大量排放,被雨水吸收后形成的_______ 会污染环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是_______ 、_______ 。
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为_______ ;该反应_______ (填“属于”或“不属于”)氧化还原反应。

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是
②在工业生产中,B气体大量排放,被雨水吸收后形成的
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为
您最近一年使用:0次
2 .  和氮氧化物(
和氮氧化物( )都是大气污染物,科学处理及综合利用是科学研究热点。
)都是大气污染物,科学处理及综合利用是科学研究热点。
Ⅰ. 净化工业
净化工业
(1)常温常压条件下,某科研小组将含有 的烟气通入0.4 mol⋅L
的烟气通入0.4 mol⋅L 的
的 溶液,pH对烟气吸收过程的影响如图所示。
溶液,pH对烟气吸收过程的影响如图所示。 并随尾气排出,导致硫的总吸收效率下降。请描述
并随尾气排出,导致硫的总吸收效率下降。请描述 产生的过程
产生的过程___________ 。
②当pH处于8~3时,硫的总吸收率增大的原因是生成的硫代硫酸铵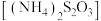 和
和 一定条件下发生反应,有S和
一定条件下发生反应,有S和 生成,该反应的化学方程式为
生成,该反应的化学方程式为___________ 。
③实验证实,当温度高于70℃时,吸收率会大幅下降,其原因是___________ 。
Ⅱ.液相络合还原法
(2) 与EDTA配置成的液相体系[Fe(Ⅱ)EDTA],可与NO生成一种络合物,再用尿素将络合的NO还原脱除。
与EDTA配置成的液相体系[Fe(Ⅱ)EDTA],可与NO生成一种络合物,再用尿素将络合的NO还原脱除。
若向“Fe(Ⅱ)EDTA+尿素”体系中添加 (已知该条件下
(已知该条件下 对NO无还原能力),NO的脱除率变化如图所示。加入
对NO无还原能力),NO的脱除率变化如图所示。加入 能使NO脱除率增大的原因是
能使NO脱除率增大的原因是___________ 。 还原
还原 技术
技术
(3)某种使用钒催化剂的 还原技术,能够有效脱除烟气中的氮氧化物。该技术的机理如图所示。
还原技术,能够有效脱除烟气中的氮氧化物。该技术的机理如图所示。___________ 。
②当1 mol 脱除了1 mol NO时,理论上还需通入标况下
脱除了1 mol NO时,理论上还需通入标况下 的体积为
的体积为___________ 。
 和氮氧化物(
和氮氧化物( )都是大气污染物,科学处理及综合利用是科学研究热点。
)都是大气污染物,科学处理及综合利用是科学研究热点。Ⅰ.
 净化工业
净化工业(1)常温常压条件下,某科研小组将含有
 的烟气通入0.4 mol⋅L
的烟气通入0.4 mol⋅L 的
的 溶液,pH对烟气吸收过程的影响如图所示。
溶液,pH对烟气吸收过程的影响如图所示。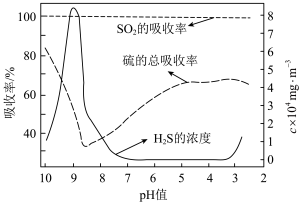
 并随尾气排出,导致硫的总吸收效率下降。请描述
并随尾气排出,导致硫的总吸收效率下降。请描述 产生的过程
产生的过程②当pH处于8~3时,硫的总吸收率增大的原因是生成的硫代硫酸铵
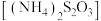 和
和 一定条件下发生反应,有S和
一定条件下发生反应,有S和 生成,该反应的化学方程式为
生成,该反应的化学方程式为③实验证实,当温度高于70℃时,吸收率会大幅下降,其原因是
Ⅱ.液相络合还原法
(2)
 与EDTA配置成的液相体系[Fe(Ⅱ)EDTA],可与NO生成一种络合物,再用尿素将络合的NO还原脱除。
与EDTA配置成的液相体系[Fe(Ⅱ)EDTA],可与NO生成一种络合物,再用尿素将络合的NO还原脱除。若向“Fe(Ⅱ)EDTA+尿素”体系中添加
 (已知该条件下
(已知该条件下 对NO无还原能力),NO的脱除率变化如图所示。加入
对NO无还原能力),NO的脱除率变化如图所示。加入 能使NO脱除率增大的原因是
能使NO脱除率增大的原因是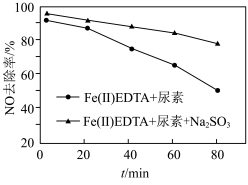
 还原
还原 技术
技术(3)某种使用钒催化剂的
 还原技术,能够有效脱除烟气中的氮氧化物。该技术的机理如图所示。
还原技术,能够有效脱除烟气中的氮氧化物。该技术的机理如图所示。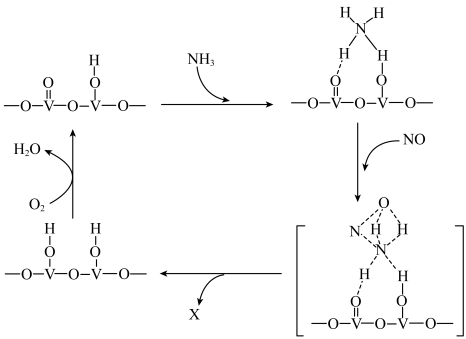
②当1 mol
 脱除了1 mol NO时,理论上还需通入标况下
脱除了1 mol NO时,理论上还需通入标况下 的体积为
的体积为
您最近一年使用:0次
3 . 硫的化合物在生产、生活和科学研究中有着广泛的应用。在自然资源的开发和利用中需要防治环境污染。
(1) 可用于以硝酸为原料生产亚硝酸钠的工业生产。按一定计量比通
可用于以硝酸为原料生产亚硝酸钠的工业生产。按一定计量比通 和喷入硝酸,若反应后生成的NO与
和喷入硝酸,若反应后生成的NO与 物质的量之比恰好
物质的量之比恰好 ,反应物
,反应物 和
和 的物质的量之比为
的物质的量之比为___________ 。
(2)脱除硫酸工业的二氧化硫尾气常有石灰石-石膏法和氨脱硫法,其产物可进一步转化为有重要应用价值的硫酸钾、亚硫酸铵等物质。
①硫酸工业制备中,以硫铁矿(FeS2)制备 的反应中,化合价升高的元素为
的反应中,化合价升高的元素为___________ (填元素符号)。
②石灰石法脱除烟气中 的化学方程式为
的化学方程式为___________ 。
研究发现:pH和温度对石灰石浆液的脱硫效率产生一定影响,当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示。___________ (填标号)。
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.石灰石浆液 ,烟气脱硫效果降低的原因是石灰石的溶解度增大
,烟气脱硫效果降低的原因是石灰石的溶解度增大
c.反应时需鼓入足量的空气以保证 被充分氧化生成
被充分氧化生成
d.将脱硫后的气体通入 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率
③ 可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种铵态氮肥。用
可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种铵态氮肥。用 溶液吸收NO的离子方程式为
溶液吸收NO的离子方程式为___________ ,检验 试剂是否被氧气氧化的实验操作为
试剂是否被氧气氧化的实验操作为___________ 。
(3) 在一定条件下能有效去除烟气中的
在一定条件下能有效去除烟气中的 、NO,其可能的反应机理如下图所示(HO·表示羟基自由基,其中O元素为-1价,·表示未成对电子),该过程可描述为
、NO,其可能的反应机理如下图所示(HO·表示羟基自由基,其中O元素为-1价,·表示未成对电子),该过程可描述为___________ (从氧化还原反应角度)。
(1)
 可用于以硝酸为原料生产亚硝酸钠的工业生产。按一定计量比通
可用于以硝酸为原料生产亚硝酸钠的工业生产。按一定计量比通 和喷入硝酸,若反应后生成的NO与
和喷入硝酸,若反应后生成的NO与 物质的量之比恰好
物质的量之比恰好 ,反应物
,反应物 和
和 的物质的量之比为
的物质的量之比为(2)脱除硫酸工业的二氧化硫尾气常有石灰石-石膏法和氨脱硫法,其产物可进一步转化为有重要应用价值的硫酸钾、亚硫酸铵等物质。
①硫酸工业制备中,以硫铁矿(FeS2)制备
 的反应中,化合价升高的元素为
的反应中,化合价升高的元素为②石灰石法脱除烟气中
 的化学方程式为
的化学方程式为研究发现:pH和温度对石灰石浆液的脱硫效率产生一定影响,当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示。

a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.石灰石浆液
 ,烟气脱硫效果降低的原因是石灰石的溶解度增大
,烟气脱硫效果降低的原因是石灰石的溶解度增大c.反应时需鼓入足量的空气以保证
 被充分氧化生成
被充分氧化生成
d.将脱硫后的气体通入
 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率③
 可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种铵态氮肥。用
可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种铵态氮肥。用 溶液吸收NO的离子方程式为
溶液吸收NO的离子方程式为 试剂是否被氧气氧化的实验操作为
试剂是否被氧气氧化的实验操作为(3)
 在一定条件下能有效去除烟气中的
在一定条件下能有效去除烟气中的 、NO,其可能的反应机理如下图所示(HO·表示羟基自由基,其中O元素为-1价,·表示未成对电子),该过程可描述为
、NO,其可能的反应机理如下图所示(HO·表示羟基自由基,其中O元素为-1价,·表示未成对电子),该过程可描述为
您最近一年使用:0次
解题方法
4 . 根据所学知识填写下列空白
(1)下列叙述中正确的有___________ (填序号)。
①NaCl溶液在电流的作用下电离成钠离子和氯离子
②强电解质溶液的导电性比弱电解质溶液的导电性强
③CO2的水溶液导电能力很弱,所以CO2是弱电解质
④BaSO4溶于水的部分能够完全电离,故它是强电解质
⑤在强电解质的水溶液中只有离子没有分子
⑥氯水能导电,所以Cl2是电解质
⑦乙醇和乙酸都能溶于水,都是电解质
(2)KHCO3在水溶液中的电离方程式为___________ ,若向其中加入少量Ba(OH)2溶液,反应的离子方程式为___________ 。
(3)在标准状况下,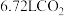 质量为
质量为___________  ,其中含有的氧原子数目约为
,其中含有的氧原子数目约为___________ 。
(4)在标准状况下,NO和NO2的混合气体共33.6 L,质量为53 g,该混合气体中NO与NO2的体积之比为___________ 。
(5) 是一种酸性氧化物,可制取
是一种酸性氧化物,可制取 ,从括号内所给试剂(
,从括号内所给试剂( 溶液、
溶液、 溶液、
溶液、 溶液)中选择合适的,完成这一反应,写出该反应的化学方程式:
溶液)中选择合适的,完成这一反应,写出该反应的化学方程式:___________ 。
(6) 可经过如图所示的转化制取
可经过如图所示的转化制取 ,已知“反应Ⅱ”为复分解反应。
,已知“反应Ⅱ”为复分解反应。___________ 。
②过滤后对沉淀进行洗涤,检验沉淀是否洗涤干净的操作为___________ 。
(1)下列叙述中正确的有
①NaCl溶液在电流的作用下电离成钠离子和氯离子
②强电解质溶液的导电性比弱电解质溶液的导电性强
③CO2的水溶液导电能力很弱,所以CO2是弱电解质
④BaSO4溶于水的部分能够完全电离,故它是强电解质
⑤在强电解质的水溶液中只有离子没有分子
⑥氯水能导电,所以Cl2是电解质
⑦乙醇和乙酸都能溶于水,都是电解质
(2)KHCO3在水溶液中的电离方程式为
(3)在标准状况下,
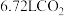 质量为
质量为 ,其中含有的氧原子数目约为
,其中含有的氧原子数目约为(4)在标准状况下,NO和NO2的混合气体共33.6 L,质量为53 g,该混合气体中NO与NO2的体积之比为
(5)
 是一种酸性氧化物,可制取
是一种酸性氧化物,可制取 ,从括号内所给试剂(
,从括号内所给试剂( 溶液、
溶液、 溶液、
溶液、 溶液)中选择合适的,完成这一反应,写出该反应的化学方程式:
溶液)中选择合适的,完成这一反应,写出该反应的化学方程式:(6)
 可经过如图所示的转化制取
可经过如图所示的转化制取 ,已知“反应Ⅱ”为复分解反应。
,已知“反应Ⅱ”为复分解反应。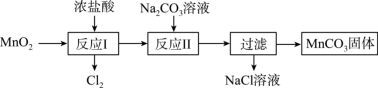
②过滤后对沉淀进行洗涤,检验沉淀是否洗涤干净的操作为
您最近一年使用:0次
5 . 根据所学知识填写下列空白:
(1)现有下列十种物质:①HCl气体②石墨③CH4④酒精⑤KHSO3溶液⑥SiO2⑦CuSO4·5H2O⑧熔融Na2SO4⑨液氨⑩Ba(OH)2溶液。所给状态能导电的是_______ (填所给物质的序号,以下相同);属于电解质的是_______ ,属于非电解质的是_______ 。
(2)某固体A在一定条件下加热分解,产物B为气体,A的分解反应为:2A(s) = 5B(g)。现测得相同条件下,B气体密度与H2密度比值为d∶1,则A的摩尔质量为_______ g/mol(填含d的表达式)。
(3)NaClO2溶液可同时吸收含有SO2、NO的烟气。反应温度为323K,NaClO2溶液浓度为5×10-3mol/L。在碱性环境中,反应一段时间后溶液中离子浓度的分析结果如表。
脱硫过程中SO2主要转化为SO ,则脱硝过程NO主要转化为
,则脱硝过程NO主要转化为_______ (填离子符号),脱硝过程主要反应的离子方程式为_______ 。
(1)现有下列十种物质:①HCl气体②石墨③CH4④酒精⑤KHSO3溶液⑥SiO2⑦CuSO4·5H2O⑧熔融Na2SO4⑨液氨⑩Ba(OH)2溶液。所给状态能导电的是
(2)某固体A在一定条件下加热分解,产物B为气体,A的分解反应为:2A(s) = 5B(g)。现测得相同条件下,B气体密度与H2密度比值为d∶1,则A的摩尔质量为
(3)NaClO2溶液可同时吸收含有SO2、NO的烟气。反应温度为323K,NaClO2溶液浓度为5×10-3mol/L。在碱性环境中,反应一段时间后溶液中离子浓度的分析结果如表。
| 离子 | SO | SO | NO | NO | Cl- |
| C/(mol/L) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-6 | 3.4×10-3 |
 ,则脱硝过程NO主要转化为
,则脱硝过程NO主要转化为
您最近一年使用:0次
6 . 已知二氧化碳、二氧化硫等都只能与碱反应生成相应的盐和水,这些氧化物为酸性氧化物;氧化铜、氧化铁等都只能与酸反应生成盐和水,这些氧化物为碱性氧化物;而氧化铝既能与酸反应又能与碱反应生成盐和水,因此氧化铝为两性氧化物。
(1)现有①三氧化铬、②二氧化硅、③氧化钠、④氧化钙、⑤氧化锌5种氧化物,其中三氧化铬、二氧化硅、氧化锌可与碱反应生成盐和水;氧化钠、氧化钙、氧化锌可与酸反应生成盐和水。这5种氧化物中:属于酸性氧化物的是___________ (填序号,下同);属于碱性氧化物的是___________ ;属于两性氧化物的是___________ 。
(2)请写出下列反应的化学方程式:
①二氧化硫和氧化钙___________ ;
②二氧化硫和过量氢氧化钠溶液___________ ;
③氧化钠和稀盐酸___________ ;
④氧化钠和水___________ 。
(1)现有①三氧化铬、②二氧化硅、③氧化钠、④氧化钙、⑤氧化锌5种氧化物,其中三氧化铬、二氧化硅、氧化锌可与碱反应生成盐和水;氧化钠、氧化钙、氧化锌可与酸反应生成盐和水。这5种氧化物中:属于酸性氧化物的是
(2)请写出下列反应的化学方程式:
①二氧化硫和氧化钙
②二氧化硫和过量氢氧化钠溶液
③氧化钠和稀盐酸
④氧化钠和水
您最近一年使用:0次
名校
解题方法
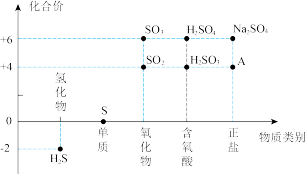
7 . 硫及其部分化合物的“价类二维图”如下图所示,回答下列问题:___________ ,含有的化学键类型为___________ 。
(2)某实验小组为了验证固体A中含有碳酸钠杂质,选用下列装置进行实验:___________ (填选项字母),丁中反应的离子方程式___________ 。
A.abcfhde B.afhedbc C.afhdebc
②能证明固体A中含有碳酸钠的实验现象是___________ 。
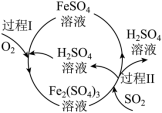
(3)某化工厂用如图所示工艺流程除去燃煤产生的SO2.标准状况下,当除去11.2L SO2时, 消耗O2的物质的量为___________ mol。___________ (用化学方程式表示)。
(2)某实验小组为了验证固体A中含有碳酸钠杂质,选用下列装置进行实验:
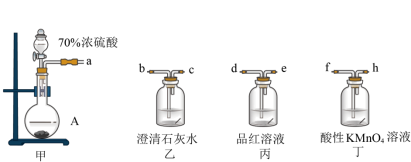
A.abcfhde B.afhedbc C.afhdebc
②能证明固体A中含有碳酸钠的实验现象是
(3)某化工厂用如图所示工艺流程除去燃煤产生的SO2.标准状况下,当除去11.2L SO2时, 消耗O2的物质的量为
您最近一年使用:0次
8 . 如图, 溶液与
溶液与 溶液反应:
溶液反应: ,产生蓝色沉淀,推测
,产生蓝色沉淀,推测 与
与 反应的离子方程式是
反应的离子方程式是___________ 。
(2)另取红棕色溶液少许,检测其为胶体,向其中继续滴加 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是___________ 。
 溶液与
溶液与 溶液反应:
溶液反应: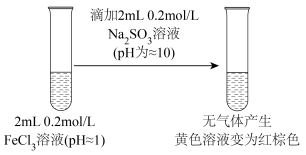
 ,产生蓝色沉淀,推测
,产生蓝色沉淀,推测 与
与 反应的离子方程式是
反应的离子方程式是(2)另取红棕色溶液少许,检测其为胶体,向其中继续滴加
 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
您最近一年使用:0次
解题方法
9 . 回答下列问题
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:___________ 。
(2)X与Z反应中氧化剂与还原剂的物质的量之比为___________ 。
(3) 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为___________ 。
(4)铜和M的浓溶液反应生成Z的化学方程式为___________ ;若要证明该反应产物有 ,需要采取的操作是
,需要采取的操作是___________ 。
(Ⅱ)氮氧化物( )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。
方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式___________ 。
方案2:
(6)工业生产中利用氨水吸收少量 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是___________ 。
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:
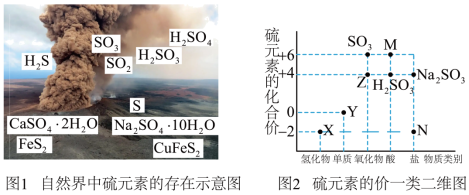
(2)X与Z反应中氧化剂与还原剂的物质的量之比为
(3)
 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为(4)铜和M的浓溶液反应生成Z的化学方程式为
 ,需要采取的操作是
,需要采取的操作是(Ⅱ)氮氧化物(
 )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式
方案2:
(6)工业生产中利用氨水吸收少量
 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是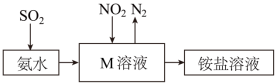
您最近一年使用:0次
2024高三·全国·专题练习
10 . 用硫酸酸化的MnO2浆液可吸收工业废气中的SO2生成MnSO4·H2O,已知浆液中MnO2含量为a%,工业废气中SO2含量为b g·m-3,SO2的吸收率可达90%,则处理1 000 m3工业尾气,可得到MnSO4·H2O的质量为___________ kg(用含字母的代数式表示)。
您最近一年使用:0次



