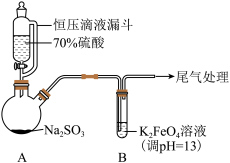
1 . 某实验小组探究SO2与K2FeO4的反应,实验如下。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;
(1)A中产生SO2的化学方程式为___________ 。
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO 、SO
、SO ,检验如下:
,检验如下:
实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在___________ 。另取少量溶液滴加BaCl2溶液,产生白色沉淀,但不能确认含有SO ,原因是
,原因是___________ 。
实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO 。
。
实验三中用H2C2O4溶液溶解沉淀的目的是:___________ 。
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:___________ 。
(3)查阅资料:a.Fe3+、SO 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是___________ 。
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:___________ 。
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O
 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;| 装置 | 操作及现象 |
| 实验一:向B中通入SO2,产生暗红褐色沉淀X和溶液Y(略显红色);继续通入SO2一段时间后,溶液呈红色,继而变为橙色,最终沉淀消失,溶液几乎无色。 |
(1)A中产生SO2的化学方程式为
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO
 、SO
、SO ,检验如下:
,检验如下:实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在
 ,原因是
,原因是实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO
 。
。实验三中用H2C2O4溶液溶解沉淀的目的是:
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:
(3)查阅资料:a.Fe3+、SO
 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。
 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
您最近一年使用:0次
2 . 某化学实验小组探究 与
与 溶液的反应。
溶液的反应。
实验一:用如图所示实验装置制备 ,并将足量
,并将足量 通入
通入 溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
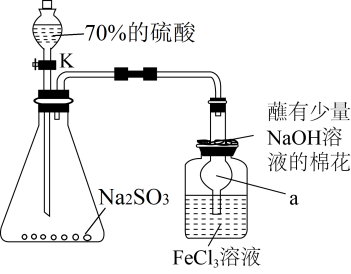
(1)制备 的化学反应方程式为
的化学反应方程式为___________ 。
(2)仪器 的名称为
的名称为___________ 。
(3)某同学取适量酸性 于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有
于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有 ,此结论
,此结论___________ (填“正确”、“不正确”),理由是___________ 。
实验二:探究血红色溶液产生的原因
实验过程如下表:
(4)实验①中, 是
是___________ (填化学式);实验②中现象是___________ 。
(5)为了进一步探究血红色物质产生的主要原因,又进行了以下实验:在
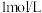 的
的 溶液中,加入浓度相同的
溶液中,加入浓度相同的 溶液
溶液 ,
, 溶液
溶液 并混合均匀,改变
并混合均匀,改变 、
、 的值并维持
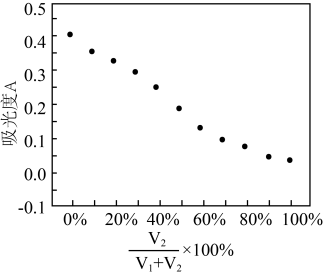
的值并维持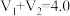 进行多组实验,测得混合溶液的吸光度与
进行多组实验,测得混合溶液的吸光度与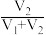 出的关系如图所示。(已知吸光度越大,溶液颜色越深)。
出的关系如图所示。(已知吸光度越大,溶液颜色越深)。
①维持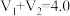 的目的是
的目的是___________ 。
②该实验得出的结论是___________ 。
 与
与 溶液的反应。
溶液的反应。实验一:用如图所示实验装置制备
 ,并将足量
,并将足量 通入
通入 溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
(1)制备
 的化学反应方程式为
的化学反应方程式为(2)仪器
 的名称为
的名称为(3)某同学取适量酸性
 于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有
于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有 ,此结论
,此结论实验二:探究血红色溶液产生的原因
实验过程如下表:
| 实验序号 | 假设 | 实验内容 | 结论 |
| ① |  增大 增大 | 取上述血红色溶液,滴入 溶液,溶液又变为黄色 溶液,溶液又变为黄色 | 假设不成立 |
| ② |  和 和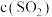 增大 增大 | 在 溶液中,滴入 溶液中,滴入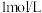  溶液,溶液呈血红色,再逐渐滴入 溶液,溶液呈血红色,再逐渐滴入 溶液,出现 溶液,出现 | 假设不成立 |
| ③ | 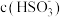 或 或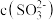 增大 增大 | 在 溶液中加入 溶液中加入 溶液,立即变为血红色 溶液,立即变为血红色 | 假设成立 |
 是
是(5)为了进一步探究血红色物质产生的主要原因,又进行了以下实验:在

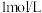 的
的 溶液中,加入浓度相同的
溶液中,加入浓度相同的 溶液
溶液 ,
, 溶液
溶液 并混合均匀,改变
并混合均匀,改变 、
、 的值并维持
的值并维持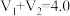 进行多组实验,测得混合溶液的吸光度与
进行多组实验,测得混合溶液的吸光度与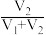 出的关系如图所示。(已知吸光度越大,溶液颜色越深)。
出的关系如图所示。(已知吸光度越大,溶液颜色越深)。
①维持
 的目的是
的目的是②该实验得出的结论是
您最近一年使用:0次
名校
解题方法
3 . 实验室探究NaHSO3溶液与Cu2+的反应。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是____ 。
(2)写出C中制备NaHSO3的离子方程式____ 。
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:
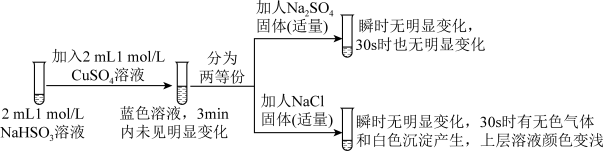
已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO 的还原性
的还原性
b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是_____ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
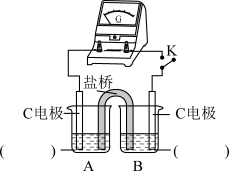
ⅰ.补全电化学装置示意图____ 。
ⅱ.写出B中的电极反应方程式____ 。
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,____ ,使HSO 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+ HAuCl4
HAuCl4
(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:____ 。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备NaHSO3的离子方程式
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:

已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO
 的还原性
的还原性b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 | 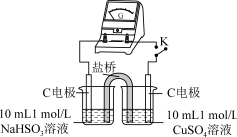 | 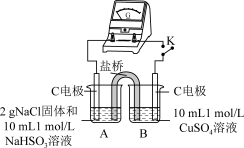 |
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

ⅰ.补全电化学装置示意图
ⅱ.写出B中的电极反应方程式
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,
 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+
 HAuCl4
HAuCl4(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:
您最近一年使用:0次
名校
解题方法
4 . 实验小组设计图所示装置,验证SO2性质,对实验现象分析不正确的是

| A.通入SO2一段时间后,试管内时的CCl4溶液逐渐褪色,说明SO2具有还原性 |
| B.一段时间后试管内有白色沉淀,说明SO2与BaCl2反应生成BaSO3沉淀 |
| C.试管中的红色花瓣颜色变浅,说明SO2溶于水具有漂白性 |
| D.滴有酚酞的NaOH溶液红色变浅,说明SO2能与碱溶液反应 |
您最近一年使用:0次
2021-05-22更新
|
2254次组卷
|
11卷引用:北京市石景山区2021届高三一模化学试题
北京市石景山区2021届高三一模化学试题2021年北京高考化学试题变式题1-10(已下线)【浙江新东方】高中化学20210513-041【2021】【高一下】(已下线)第13讲 硫及其化合物(精练)-2022年高考化学一轮复习讲练测(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)江苏省苏州实验中学2021-2022学年第高一上学期12月月考调研化学试题广东省潮州市潮安区宝山中学2021-2022学年高一下学期期中考试化学试题(已下线)第13讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)湖北省武汉海淀外国语实验学校2022-2023学年高三上学期10月月考化学试题安徽省当涂第一中学2023-2024学年高二上学期开学考试化学试题
5 . 化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
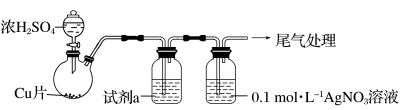
①浓H2SO4与Cu反应的化学方程式是____________________________________ 。
②试剂a是____________ 。
(2)对体系中有关物质性质分析得出:沉淀B可能为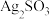 、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:__________ 。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是__________ 。
(3)根据沉淀F的存在,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
实验三:探究 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________ :取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______ 。
②实验三的结论:__________ 。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________ 。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和 生成。
生成。
(6)根据上述实验所得结论:__________________ 。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。

①浓H2SO4与Cu反应的化学方程式是
②试剂a是
(2)对体系中有关物质性质分析得出:沉淀B可能为
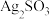 、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是
(3)根据沉淀F的存在,推测
 的产生有两个途径:
的产生有两个途径:途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。实验三:探究
 的产生途径
的产生途径①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有
②实验三的结论:
(4)实验一中SO2与AgNO3溶液反应的离子方程式是
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和
 生成。
生成。(6)根据上述实验所得结论:
您最近一年使用:0次
2019-06-09更新
|
10188次组卷
|
23卷引用:2019年北京高考化学试题
2019年北京高考化学试题北京市第一〇一中学2021届高三上学期9月月考化学试题(已下线)T28-实验探究题北京市第九中学2023-2024学年高二下学期2月开学考化学试题(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》人教版(2019)必修第二册第五章 模拟高考必修第二册RJ第5章挑战区 模拟高考湖南省长沙市雅礼中学2021届高三上学期第一次月考化学试题人教版2019必修第二册 第五章 第一节综合拔高练(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向14 物质制备探究-备战2022年高考化学一轮复习考点微专题(已下线)考向12 硫及其化合物-备战2022年高考化学一轮复习考点微专题(已下线)第7周 晚练题-备战2022年高考化学周测与晚练(新高考专用)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题(已下线)专题讲座(十)化学实验设计与探究(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)2021年广东省高考化学试卷变式题11-21(已下线)专题02 定性探究-【微专题·大素养】备战2022年高考化学核心突破(实验综合大题)(已下线)必刷卷05-2022年高考化学考前信息必刷卷(全国甲卷)(已下线)专题十六实验设计与探究实验江苏省海安市实验中学2022-2023学年高一第一次月考化学试题广东省湛江市普通高中2023届高三下学期4月模拟考试化学试题(已下线)专题19 实验综合题
名校
6 . 甲、乙两组同学用不同的方法制备SO2并探究其性质。(夹持装置已略去)
I.甲组同学设计的实验装置如图所示,回答下列问题:
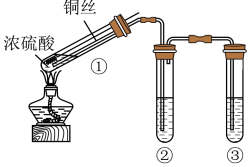
(1)试管①中反应的化学方程式是__________ 。
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是__________ 。
(3)试管③中的试剂是NaOH溶液,反应的离子方程式 是___________ 。
Ⅱ .乙组同学设计的实验装置如下图所示,回答下列问题:
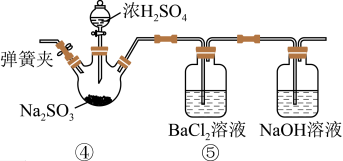
已知: BaSO3是白色难溶于水的物质,但可溶解于盐酸。
(4)④中反应的化学方程式是__________ 。
(5)⑤中产生了不溶于盐酸的白色沉淀,该沉淀是___________ 。
(6)经过分析,乙组同学认为装置中的空气是出现白色沉淀的原因。他们在不改变实验装置的情况下加入了某操作过程,证实了这种猜测是正确的。他们的操作及实验现象 是__________ 。
I.甲组同学设计的实验装置如图所示,回答下列问题:

(1)试管①中反应的化学方程式是
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是
(3)试管③中的试剂是NaOH溶液,反应的
Ⅱ .乙组同学设计的实验装置如下图所示,回答下列问题:

已知: BaSO3是白色难溶于水的物质,但可溶解于盐酸。
(4)④中反应的化学方程式是
(5)⑤中产生了不溶于盐酸的白色沉淀,该沉淀是
(6)经过分析,乙组同学认为装置中的空气是出现白色沉淀的原因。他们在不改变实验装置的情况下加入了某操作过程,证实了这种猜测是正确的。他们的
您最近一年使用:0次
2019-03-03更新
|
640次组卷
|
4卷引用:北京市师范大学附属中学2018-2019学年高一上学期期末考试化学试题