解题方法
1 . 实验室可用下列装置(夹持装置已略,无加热装置)制备少量Na2S2O3·5H2O。已知Na2SO3在溶液中易结块。下列说法不正确的是
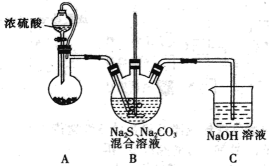

| A.装置A的蒸馏烧瓶中盛放的药品可能是亚硫酸钠 |
| B.装置B中反应物的理论投料比为n(Na2CO3):n(Na2S)=2:1 |
| C.装置C用于吸收未参与反应的SO2 |
| D.反应完成后,三颈烧瓶中液体需经过滤、蒸发浓缩、冷却结晶、过滤及干燥得到产品 |
您最近一年使用:0次
解题方法
2 . 实验室 与浓
与浓 反应的实验装置改进如图。下列说法错误的是
反应的实验装置改进如图。下列说法错误的是

 与浓
与浓 反应的实验装置改进如图。下列说法错误的是
反应的实验装置改进如图。下列说法错误的是
A.装置乙用于检验 |
B.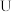 型管中可放置石灰,以吸收 型管中可放置石灰,以吸收 防止污染空气 防止污染空气 |
| C.伸入或者上提铜丝,可以控制反应的发生和停止 |
D.实验结束后,立即将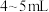 水加入试管甲,观察溶液颜色 水加入试管甲,观察溶液颜色 |
您最近一年使用:0次
3 . MnSO4·H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:

下列说法错误的是

下列说法错误的是
| A.装置Ⅰ烧瓶中放入的药品X为铜屑 |
| B.装置Ⅱ中用“多孔球泡”可增大SO2的吸收速率 |
| C.装置Ⅲ用于吸收未反应的SO2 |
| D.用装置II反应后的溶液降温结晶可制得MnSO4·H2O晶体 |
您最近一年使用:0次
2019-08-25更新
|
177次组卷
|
2卷引用:安徽省宣城市2018-2019学年高二下学期期末考试化学试题
4 . 硫酸是当今世界最重要的化工产品之一,有关硫酸制备和性质实验如下:
Ⅰ.(1)早在1000多年前,我国就已采用加热胆矾或绿矾(FeSO4•7H2O)的方法制取硫酸。2FeSO4 Fe2O3+SO2↑+SO3↑,将受热产生的气体通入如图1的装置中,以检验产生的气体中是否含有SO2和SO3,写出甲中发生的离子反应方程式
Fe2O3+SO2↑+SO3↑,将受热产生的气体通入如图1的装置中,以检验产生的气体中是否含有SO2和SO3,写出甲中发生的离子反应方程式______ ;
(2)能说明SO2存在的实验现象是______ 。
Ⅱ.(3)实验室用图2装置制SO2,甲试管倾斜加热的目的是______ ,加热后试管内发生的化学方程式为______ 。

(4)有关该实验说法正确的是:______ 。
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将冷却后试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况)
Ⅰ.(1)早在1000多年前,我国就已采用加热胆矾或绿矾(FeSO4•7H2O)的方法制取硫酸。2FeSO4
 Fe2O3+SO2↑+SO3↑,将受热产生的气体通入如图1的装置中,以检验产生的气体中是否含有SO2和SO3,写出甲中发生的离子反应方程式
Fe2O3+SO2↑+SO3↑,将受热产生的气体通入如图1的装置中,以检验产生的气体中是否含有SO2和SO3,写出甲中发生的离子反应方程式(2)能说明SO2存在的实验现象是
Ⅱ.(3)实验室用图2装置制SO2,甲试管倾斜加热的目的是

(4)有关该实验说法正确的是:
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将冷却后试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况)
您最近一年使用:0次
名校
解题方法
5 . 实验室为探究铜与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是( )


| A.装置B、C的目的分别是验证二氧化硫的还原性、氧化性 |
| B.实验结束后可向装置A的溶液中加水,以验证是否有蓝色溶液生成 |
| C.装置D的目的是验证SO2的漂白性及漂白的不稳定性 |
| D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |
您最近一年使用:0次
名校
6 . 现有如下所示4个装置图,以下说法中正确的是
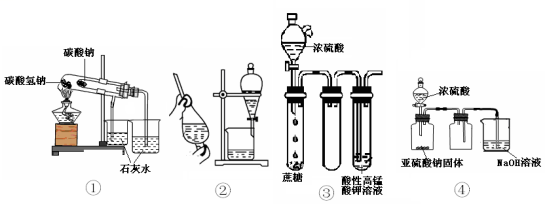

| A.①装置可用于比较NaHCO3和Na2CO3的稳定性 | B.用酒精萃取溴水中的溴可选择②装置 |
| C.如③装置进行实验可看到酸性KMnO4溶液褪色 | D.④装置可用于实验室制取并收集少量SO2 |
您最近一年使用:0次
2019-01-18更新
|
225次组卷
|
3卷引用:【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期期末考试化学试题
7 . 实验室探究SO2性质的装置如图所示。下列说法错误的是( )


| A.装置a中的反应可用铜片和浓硫酸代替 |
| B.若X为H2S溶液,装置b中产生淡黄色沉淀 |
| C.若X为含HCl、BaCl2的FeCl3溶液,装置b中产生白色沉淀 |
| D.反应后装置c中溶液的pH降低 |
您最近一年使用:0次
2020-06-08更新
|
522次组卷
|
5卷引用:广东省广州市2020届高三综合测试(二)理科综合化学试题
名校
解题方法
8 . 下列有关铜与过量浓硫酸反应的实验说法不正确 的是


| A.喷有碱液的棉花是为了防止SO2污染环境 |
| B.将水注入反应后冷却的试管a中,溶液变为蓝色 |
| C.铜片表面先发黑,反应完全后试管a底部有灰白色固体 |
| D.SO2 能使 KMnO4 水溶液褪色 |
您最近一年使用:0次
解题方法
9 . 某学习小组为了验证SO2的还原性并测定产生SO2的质量,组装了下图装置。回答下列问题:

(1)C中发生反应的化学方程式是________ ,B装置的名称是_________ ,关于该套装置说法正确的是_________ (填标号)。
a 组装仪器、加入药品后检查气密性 b 实验开始和最后时均需要通入空气
c 利用A、B装置是为了减小实验误差 d F、G中的碱石灰可以换为无水CaCl2
(2)甲同学认为很快可以看到D装置的现象,他的依据是_________ (用离子方程式表示)。乙同学做实验时发现和甲同学预测的现象不一样,先出现棕红色,经过一段时间后变为浅绿色。于是查阅资料发现反应分为两步:
第一步: (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
如果需要验证第一步反应是快反应,可以事先在D装置中滴加数滴_________ 试剂,相应的实验现象是________ 。
(3)学习小组通过实验后D和F装置中的数据来计算SO2的质量。D中加入足量的BaCl2溶液充分反应,经过________ 操作,测得沉淀为m1g,F的质量差为m2g,C中产生SO2的体积(标准状况下)为_________ L。该实验的设计中,仍然存在系统误差的可能原因是______ 。

(1)C中发生反应的化学方程式是
a 组装仪器、加入药品后检查气密性 b 实验开始和最后时均需要通入空气
c 利用A、B装置是为了减小实验误差 d F、G中的碱石灰可以换为无水CaCl2
(2)甲同学认为很快可以看到D装置的现象,他的依据是
第一步:
 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)如果需要验证第一步反应是快反应,可以事先在D装置中滴加数滴
(3)学习小组通过实验后D和F装置中的数据来计算SO2的质量。D中加入足量的BaCl2溶液充分反应,经过
您最近一年使用:0次
2020-04-12更新
|
314次组卷
|
2卷引用:广东省深圳市2020届高三下学期第二次线上测试(全国I卷)理综化学试题
10 . 硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1) 仪器A冷却水的进口_______ (填“a”或“b”)。
(2) 仪器B中盛放的药品是_______ 。
(3) 实验所需二氧化硫用亚硫酸钠与硫酸制备,该反应的离子方程式为_______ ,以下与二氧化硫有关的说法中正确的是_______ 。
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
E.可用浓硫酸干燥SO2
F.可用澄清的石灰水鉴别SO2和CO2
(4) 装置丙所盛试剂为_______ ,若缺少装置乙,则硫酰氯会损失,该反应的化学方程为______________ 。
(5) 少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H===H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是______________ 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)____ 。
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |

(1) 仪器A冷却水的进口
(2) 仪器B中盛放的药品是
(3) 实验所需二氧化硫用亚硫酸钠与硫酸制备,该反应的离子方程式为
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
E.可用浓硫酸干燥SO2
F.可用澄清的石灰水鉴别SO2和CO2
(4) 装置丙所盛试剂为
(5) 少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H===H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)
您最近一年使用:0次
2019-01-11更新
|
372次组卷
|
2卷引用:【全国百强校】四川省棠湖中学2018-2019学年高一上学期期末考试化学试题



