名校
1 . 某实验小组以BaS溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
步骤1:制备
按如图所示装置进行实验,得到 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。
步骤2:测定产品中 的含量
的含量
①称取产品1.0000g,用100mL水溶解、酸化、加热至近沸;
②在不断搅拌下,向①所得溶液中逐滴加入热的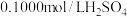 溶液,
溶液,
③沉淀完全后,经陈化、过滤、洗涤、烘干至恒重等步骤,称得白色固体质量为0.9320g。
(1)装置a的名称是___________ ,装置b中发生反应的化学方程式为___________ 。
(2)装置c的作用是___________ ,装置e中可选用的试剂是___________ (填字母)。
A.NaOH溶液 B.饱和食盐水 C.石灰乳 D.浓硫酸
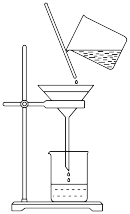
(3)如图过滤操作中不规范的有___________ 处;过滤后,洗涤沉淀的方法是___________ 。___________ 次。
(5)产品中 的质量分数为
的质量分数为___________ (保留三位有效数字)。
 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:步骤1:制备

按如图所示装置进行实验,得到
 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。步骤2:测定产品中
 的含量
的含量①称取产品1.0000g,用100mL水溶解、酸化、加热至近沸;
②在不断搅拌下,向①所得溶液中逐滴加入热的
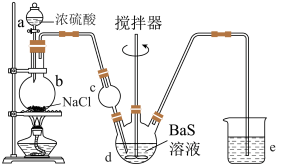
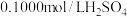 溶液,
溶液,③沉淀完全后,经陈化、过滤、洗涤、烘干至恒重等步骤,称得白色固体质量为0.9320g。
(1)装置a的名称是
(2)装置c的作用是
A.NaOH溶液 B.饱和食盐水 C.石灰乳 D.浓硫酸
(3)如图过滤操作中不规范的有
(5)产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-11-18更新
|
820次组卷
|
7卷引用:实验探究题
(已下线)实验探究题(已下线)T27-实验综合题(已下线)T15-实验综合题四川省资阳市2024届高三上学期第一次诊断性考试理综化学试题江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届广西普通高中学业水平选择性考试高三下学期模拟考试化学试卷
2 . 氯化钡(BaCl2)是一种白色晶体,易溶于水,微溶于盐酸和硝酸,难溶于乙醇和乙醚,易吸湿,常用作分析试剂、脱水剂等。以BaS溶液为原料制备BaCl2·2H2O,并用重量法测定产品中BaCl2·2H2O的含量。某兴趣小组的实验方案如下:可选用试剂:NaCl固体、BaS溶液、浓H2SO4、 稀H2SO4、CuSO4溶液、蒸馏水。
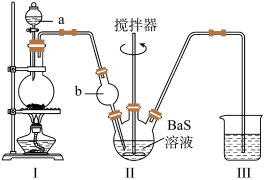
步骤1: BaCl2·2H2O的制备
按如图所示装置(部分夹持仪器已省略)进行实验,得到BaCl2溶液,经一系列操作获得BaCl2·2H2O产品。
步骤2:产品中BaCl2·2H2O含量的测定
①称取产品0.5000 g,用100 mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液中逐滴加入热的0.1000 mol· L-1 H2SO4溶液;
③沉淀完全后,在60 °C水浴中加热40 min,经过滤、洗涤、烘干等步骤,称量白色固体,其质量为0.4660g。
回答下列问题:
(1)在过滤操作中,下列仪器不需要用到的是_____________ (填名称)。
(2)装置II中仪器b的作用是___________________ ;III中的试剂应选用__________ 。
(3)装置I是制取_______ (填化学式)气体的装置,在试剂a过量并微热时,发生的主要反应的化学方程式为_________ 。
(4)沉淀过程中需加入过量的H2SO4溶液,原因是___________ 。
(5)在沉淀过程中,某同学在加入一定量热的H2SO4溶液后,认为沉淀已经完全,判断沉淀已完全的方法是_______ 。
(6)产品中BaCl2·2H2O的质量分数为_______ (保留三位有效数字)。

步骤1: BaCl2·2H2O的制备
按如图所示装置(部分夹持仪器已省略)进行实验,得到BaCl2溶液,经一系列操作获得BaCl2·2H2O产品。
步骤2:产品中BaCl2·2H2O含量的测定
①称取产品0.5000 g,用100 mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液中逐滴加入热的0.1000 mol· L-1 H2SO4溶液;
③沉淀完全后,在60 °C水浴中加热40 min,经过滤、洗涤、烘干等步骤,称量白色固体,其质量为0.4660g。
回答下列问题:
(1)在过滤操作中,下列仪器不需要用到的是

(2)装置II中仪器b的作用是
(3)装置I是制取
(4)沉淀过程中需加入过量的H2SO4溶液,原因是
(5)在沉淀过程中,某同学在加入一定量热的H2SO4溶液后,认为沉淀已经完全,判断沉淀已完全的方法是
(6)产品中BaCl2·2H2O的质量分数为
您最近一年使用:0次
3 . 某实验小组以 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
可选用试剂: 晶体、
晶体、 溶液、浓
溶液、浓 、稀
、稀 、
、 溶液、蒸馏水
溶液、蒸馏水
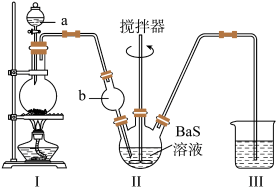
步骤1. 的制备
的制备
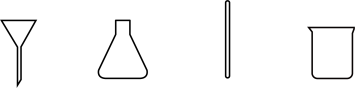
按如图所示装置进行实验,得到 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。
步骤2,产品中 的含量测定
的含量测定
①称取产品 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的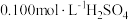 溶液,
溶液,
③沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为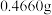 。
。
回答下列问题:
(1)Ⅰ是制取_______ 气体的装置,在试剂a过量并微热时,发生主要反应的化学方程式为_______ ;
(2)ⅠI中b仪器的作用是_______ ;Ⅲ中的试剂应选用_______ ;
(3)在沉淀过程中,某同学在加入一定量热的 溶液后,认为沉淀已经完全,判断沉淀已完全的方法是
溶液后,认为沉淀已经完全,判断沉淀已完全的方法是_______ ;
(4)沉淀过程中需加入过量的 溶液,原因是
溶液,原因是_______ ;
(5)在过滤操作中,下列仪器不需要用到的是_______ (填名称);
(6)产品中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:可选用试剂:
 晶体、
晶体、 溶液、浓
溶液、浓 、稀
、稀 、
、 溶液、蒸馏水
溶液、蒸馏水步骤1.
 的制备
的制备按如图所示装置进行实验,得到
 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。
步骤2,产品中
 的含量测定
的含量测定①称取产品
 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;②在不断搅拌下,向①所得溶液逐滴加入热的
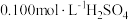 溶液,
溶液,③沉淀完全后,
 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为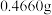 。
。回答下列问题:
(1)Ⅰ是制取
(2)ⅠI中b仪器的作用是
(3)在沉淀过程中,某同学在加入一定量热的
 溶液后,认为沉淀已经完全,判断沉淀已完全的方法是
溶液后,认为沉淀已经完全,判断沉淀已完全的方法是(4)沉淀过程中需加入过量的
 溶液,原因是
溶液,原因是(5)在过滤操作中,下列仪器不需要用到的是

(6)产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2022-06-10更新
|
11563次组卷
|
26卷引用:2022年湖南卷高考真题变式题(15-19)
(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)专题17 化学实验综合题-三年(2020-2022)高考真题分项汇编(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第29讲 化学综合实验(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题讲座(九) 化学实验中规范答题(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点10 硫元素及其化合物-备战2023年高考化学考试易错题(已下线)易错点31 化学实验常用仪器-备战2023年高考化学考试易错题(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 大题突破2 综合实验题题型研究热点2重量法(已下线)题型50 物质含量测定型综合实验(已下线)回归教材重难点11 熟记“五气体”制备实验、“两定量”测定实验-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型四 以无机物制备为载体的综合实验-备战2024年高考化学答题技巧与模板构建2022年新高考湖南化学高考真题福建省福州第一中学2022-2023学年高三上学期检考前适应性考试化学试题辽宁省营口市2022-2023学年高三上学期期末考试化学试题内蒙古赤峰二中2022-2023学年高一下学期第一次月考化学试题山东省潍坊市昌乐二中2023-2024学年高三上学期第一次月考化学试题(已下线)山东省滕州市第一中学2023-2024学年高三上学期9月份化学质量检测试题
2024高三下·全国·专题练习
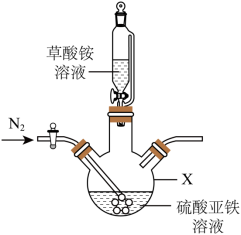
4 . 草酸亚铁晶体(FeC2O4·2H2O,难溶于水)是电池磷酸铁锂正极材料所需的主要原材料。某同学在实验室,利用废铁屑制备草酸亚铁晶体(FeC2O4·2H2O)。回答下列问题:
(1)草酸亚铁晶体制备,实验装置如图所示。_______ ;
(2)产品中FeC2O4·2H2O的质量分数测定[假设产品中杂质仅为FeSO4和(NH4)2SO4]
Ⅰ.将准确称量的ag草酸亚铁晶体样品置于250mL锥形瓶内,加入适量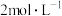 的H2SO4溶解,加热至70℃左右,立即用浓度为
的H2SO4溶解,加热至70℃左右,立即用浓度为 的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液bmL;
的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液bmL;
Ⅱ.向上述滴定混合液中加入适量的Zn粉和过量的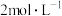 的H2SO4溶液,煮沸(不含Fe3+),继续用
的H2SO4溶液,煮沸(不含Fe3+),继续用 的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液cmL。
的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液cmL。
①步骤Ⅱ中检验溶液不含Fe3+的操作:取一滴煮沸后的溶液滴入装有_______ (填化学式)溶液的试管中,若_______ ,则说明溶液不含Fe3+。
已知 。
。
(1)草酸亚铁晶体制备,实验装置如图所示。
(2)产品中FeC2O4·2H2O的质量分数测定[假设产品中杂质仅为FeSO4和(NH4)2SO4]
Ⅰ.将准确称量的ag草酸亚铁晶体样品置于250mL锥形瓶内,加入适量
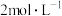 的H2SO4溶解,加热至70℃左右,立即用浓度为
的H2SO4溶解,加热至70℃左右,立即用浓度为 的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液bmL;
的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液bmL;Ⅱ.向上述滴定混合液中加入适量的Zn粉和过量的
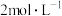 的H2SO4溶液,煮沸(不含Fe3+),继续用
的H2SO4溶液,煮沸(不含Fe3+),继续用 的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液cmL。
的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液cmL。①步骤Ⅱ中检验溶液不含Fe3+的操作:取一滴煮沸后的溶液滴入装有
已知
 。
。
您最近一年使用:0次
5 . 在测定Na2SO4和NaCl的混合物中Na2SO4的质量分数时,可以在混合物中加入过量BaCl2溶液,沉淀SO ,然后过滤、洗涤、烘干、称量得到BaSO4的质量,试问:
,然后过滤、洗涤、烘干、称量得到BaSO4的质量,试问:
(1)怎样判断SO 是否沉淀完全
是否沉淀完全_______ 。
(2)沉淀的洗涤方法_______ 。
(3)怎样判断沉淀是否洗净_______ 。
 ,然后过滤、洗涤、烘干、称量得到BaSO4的质量,试问:
,然后过滤、洗涤、烘干、称量得到BaSO4的质量,试问:(1)怎样判断SO
 是否沉淀完全
是否沉淀完全(2)沉淀的洗涤方法
(3)怎样判断沉淀是否洗净
您最近一年使用:0次
解题方法
6 . 过硫酸钠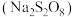 常用作漂白剂、氧化剂等。某研究小组利用如图所示装置制备
常用作漂白剂、氧化剂等。某研究小组利用如图所示装置制备 并探究其性质(加热及夹持仪器略去)。
并探究其性质(加热及夹持仪器略去)。
Ⅰ.制备

已知:①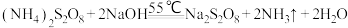
②
③ 是白色晶状粉末,易溶于水,加热至65℃就会发生分解。
是白色晶状粉末,易溶于水,加热至65℃就会发生分解。
回答下列问题:
(1)
 中过氧键的物质的量为
中过氧键的物质的量为___________ ;装置A的名称为___________ ;装置丁的作用是___________ 。
(2)实验时需要将装置甲中反应产生的 持续通入装置丙中,目的是
持续通入装置丙中,目的是___________ 。
(3)反应完毕,将三颈烧瓶中的溶液减压蒸发、结晶过滤、洗涤干燥,可得过硫酸钠,减压蒸发的原因是___________ 。
Ⅱ.探究 的氧化性
的氧化性
(4)酸性过硫酸钠溶液,在 催化作用下可以把
催化作用下可以把 氧化为
氧化为 ,该方法可用于检验
,该方法可用于检验 ,所得溶液除去
,所得溶液除去 后加入
后加入 溶液可以产生白色沉淀。
溶液可以产生白色沉淀。
①用酸性 溶液检验
溶液检验 时的实验现象为
时的实验现象为___________ 。
②该反应的离子方程式为___________ 。
(5)工业上用 测定废水中氮元素的含量:取
测定废水中氮元素的含量:取 含
含 的废水,用
的废水,用
 标准溶液滴定(氮元素被氧化为
标准溶液滴定(氮元素被氧化为 ,杂质不参加反应),达到滴定终点时消耗标准溶液的体积为
,杂质不参加反应),达到滴定终点时消耗标准溶液的体积为 ,则废水中氮元素的含量为
,则废水中氮元素的含量为___________  (用含c、V的代数式表示)。
(用含c、V的代数式表示)。
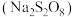 常用作漂白剂、氧化剂等。某研究小组利用如图所示装置制备
常用作漂白剂、氧化剂等。某研究小组利用如图所示装置制备 并探究其性质(加热及夹持仪器略去)。
并探究其性质(加热及夹持仪器略去)。Ⅰ.制备


已知:①
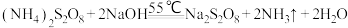
②

③
 是白色晶状粉末,易溶于水,加热至65℃就会发生分解。
是白色晶状粉末,易溶于水,加热至65℃就会发生分解。回答下列问题:
(1)

 中过氧键的物质的量为
中过氧键的物质的量为(2)实验时需要将装置甲中反应产生的
 持续通入装置丙中,目的是
持续通入装置丙中,目的是(3)反应完毕,将三颈烧瓶中的溶液减压蒸发、结晶过滤、洗涤干燥,可得过硫酸钠,减压蒸发的原因是
Ⅱ.探究
 的氧化性
的氧化性(4)酸性过硫酸钠溶液,在
 催化作用下可以把
催化作用下可以把 氧化为
氧化为 ,该方法可用于检验
,该方法可用于检验 ,所得溶液除去
,所得溶液除去 后加入
后加入 溶液可以产生白色沉淀。
溶液可以产生白色沉淀。①用酸性
 溶液检验
溶液检验 时的实验现象为
时的实验现象为②该反应的离子方程式为
(5)工业上用
 测定废水中氮元素的含量:取
测定废水中氮元素的含量:取 含
含 的废水,用
的废水,用
 标准溶液滴定(氮元素被氧化为
标准溶液滴定(氮元素被氧化为 ,杂质不参加反应),达到滴定终点时消耗标准溶液的体积为
,杂质不参加反应),达到滴定终点时消耗标准溶液的体积为 ,则废水中氮元素的含量为
,则废水中氮元素的含量为 (用含c、V的代数式表示)。
(用含c、V的代数式表示)。
您最近一年使用:0次
2022高三·全国·专题练习
7 . 实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收Cu并制备纳米ZnO的部分实验过程如图所示:

生成的 沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是
沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是_______ 。

生成的
 沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是
沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是
您最近一年使用:0次
名校
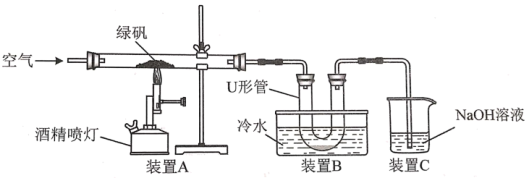
8 . 绿矾(FeSO4·7H2O)是自然界存在的一种矿石,翠绿如宝石,很早就引起人们的重视。据古籍记载,焙烧绿矾能制备铁红(主要成分是Fe2O3)。绿矾焙烧也是一种生产硫酸的古老方法。某研究性学习小组用如图所示实验装置对绿矾的焙烧反应进行探究。
完成下列填空:
(1)检验绿矾中Fe2+的方法是:取样溶于水,滴入硫氰化钾溶液,观察到无明显现象后加入_______ (填写试剂名称),观察到_______ 。
(2)实验过程中,装置A硬质玻璃管中可观察到的实验现象是_______ 。
(3)装置C的作用是_______ 。
(4)①装置B中冷水的作用是_______ 。
②请你帮助该小组同学设计实验方案证明B装置U型管中的溶液为硫酸溶液_______ 。
(5)绿矾的纯度可通过KMnO4滴定法测定。现称取2.850 g绿矾样品,配制成250 mL溶液,量取25.00 mL待测液于锥形瓶中,用硫酸酸化的0.0100 mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积的平均值为20.00 mL。
①配制250 mL绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、_______ 、胶头滴管。
②判断此实验达到滴定终点的方法是_______ 。
③计算上述样品中FeSO4·7H2O的质量分数为_______ (用小数表示,保留三位小数)。

完成下列填空:
(1)检验绿矾中Fe2+的方法是:取样溶于水,滴入硫氰化钾溶液,观察到无明显现象后加入
(2)实验过程中,装置A硬质玻璃管中可观察到的实验现象是
(3)装置C的作用是
(4)①装置B中冷水的作用是
②请你帮助该小组同学设计实验方案证明B装置U型管中的溶液为硫酸溶液
(5)绿矾的纯度可通过KMnO4滴定法测定。现称取2.850 g绿矾样品,配制成250 mL溶液,量取25.00 mL待测液于锥形瓶中,用硫酸酸化的0.0100 mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积的平均值为20.00 mL。
①配制250 mL绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、
②判断此实验达到滴定终点的方法是
③计算上述样品中FeSO4·7H2O的质量分数为
您最近一年使用:0次
2021-01-19更新
|
706次组卷
|
3卷引用:大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)
名校
9 . 保险粉Na2S2O4大量用于印染业,并用来漂白纸张、纸浆和陶土等。某化学兴趣小组同学用甲酸法制取保险粉的装置如图所示(加持装置略去)。
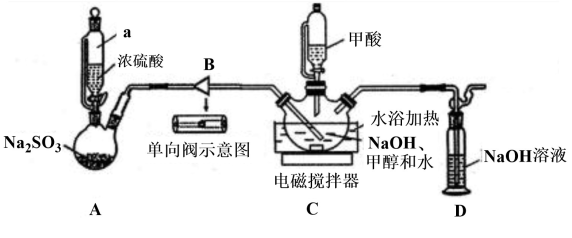
已知:保险粉易溶于水,不溶于甲醇,具有强还原性,在空气中易被氧化:2Na2S2O4+O2+2H2O=NaHSO3或Na2S2O4 +O2+H2O =NaHSO3+NaHSO4。实验时先把甲酸(HCOOH)与溶于甲醇和水混合溶剂的NaOH混合,再通入SO2气体。回答下列问题:
(1)仪器a的名称是______ ;装置B的作用是______ 。
(2)装置C中甲醇不参加反应,甲醇的作用是______ ;生成Na2S2O4的离子方程式为______ 。
(3)下列有关该实验的说法正确的是______ (填序号)。
A.可用硝酸和BaCl2溶液检验制得的Na2S2O4中是否混有NaHSO4
B.实验中甲酸和NaOH最合适的物质的量之比为1:1
C.用N2排尽装置内的空气,有利于提高 的Na2S2O4纯度
D.得到Na2S2O4固体后可用甲醇洗涤
(4)测定产品中Na2S2O4质量分数,其实验步骤如下,准确称取0.5000g产品放入锥形瓶中,加入适量水使其溶解。然后加入足量甲醛,充分反应,再滴加几滴指示剂,用0.2000mol·L-1的标准I2溶液滴定,至终点时,消耗25.00mL标准I2溶液。实验过程中涉及的反应:Na2S2O4+2HCHO+H2O =NaHSO3·HCHO+NaHSO2·HCHO;NaHSO2·HCHO+2I2+2H2O= NaHSO4+HCHO+4HI。该实验加入指示剂是______ ,产品Na2S2O4 (M=174g·mol-1)的质量分数为 ______ % (保留一位小数)。
(5)探究Na2S2O4的性质。隔绝空气加热Na2S2O4固体完全分解是到固体产物Na2SO3,Na2S2O3和SO2,但该兴趣小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______ 。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、KMnO4溶液)

已知:保险粉易溶于水,不溶于甲醇,具有强还原性,在空气中易被氧化:2Na2S2O4+O2+2H2O=NaHSO3或Na2S2O4 +O2+H2O =NaHSO3+NaHSO4。实验时先把甲酸(HCOOH)与溶于甲醇和水混合溶剂的NaOH混合,再通入SO2气体。回答下列问题:
(1)仪器a的名称是
(2)装置C中甲醇不参加反应,甲醇的作用是
(3)下列有关该实验的说法正确的是
A.可用硝酸和BaCl2溶液检验制得的Na2S2O4中是否混有NaHSO4
B.实验中甲酸和NaOH最合适的物质的量之比为1:1
C.用N2排尽装置内的空气,有利于提高 的Na2S2O4纯度
D.得到Na2S2O4固体后可用甲醇洗涤
(4)测定产品中Na2S2O4质量分数,其实验步骤如下,准确称取0.5000g产品放入锥形瓶中,加入适量水使其溶解。然后加入足量甲醛,充分反应,再滴加几滴指示剂,用0.2000mol·L-1的标准I2溶液滴定,至终点时,消耗25.00mL标准I2溶液。实验过程中涉及的反应:Na2S2O4+2HCHO+H2O =NaHSO3·HCHO+NaHSO2·HCHO;NaHSO2·HCHO+2I2+2H2O= NaHSO4+HCHO+4HI。该实验加入指示剂是
(5)探究Na2S2O4的性质。隔绝空气加热Na2S2O4固体完全分解是到固体产物Na2SO3,Na2S2O3和SO2,但该兴趣小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是
您最近一年使用:0次
2020-12-21更新
|
1181次组卷
|
6卷引用:培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)
(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练四川省成都市第七中学2021届高三一诊模拟考试理综化学试题江西省南昌市第二中学2021-2022学年高三上学期第一次检测理综化学试题辽宁省沈阳市第一二〇中学2021-2022学年高三上学期第四次质量监测化学试题
10-11高三上·黑龙江·阶段练习
解题方法
10 . 下列实验操作中,先后顺序正确的是
| A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水 |
| B.为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,后放入坩埚中 |
C.为检验酸性溶液中的Cl-和 ,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 ,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 |
| D.在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸 |
您最近一年使用:0次



