1 . 某学习小组将酚酞试液滴入Na2O2与水反应后的溶液中,发现溶液先变红后迅速褪色,为探究原因,查阅资料后做了分析和实验。
【查阅资料】
①Na2O2与水反应先生成H2O2,然后H2O2分解;
②H2O2类似于二元弱酸,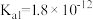 ,且具有强氧化性;
,且具有强氧化性;
③酚酞在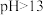 的溶液中变为无色。
的溶液中变为无色。
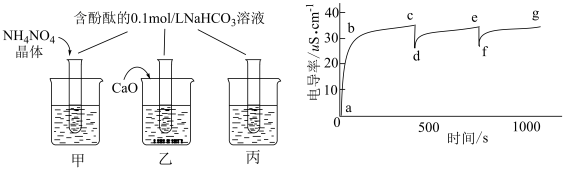
(1)探究一:褪色原因
【提出猜想】
假设一:反应产生的O2将酚酞氧化;
假设二:反应产生的H2O2将酚酞氧化;
假设三:NaOH溶液浓度过高导致酚酞试液褪色。
实验如下表,请填写空白:
【提出猜想】
(2)针对假设二,有同学提出还应补充实验才能证明Na2O2与水反应生成了 H2O2,则补充的实验操作为:________
(3)探究二:H2O2的性质及应用
①H2O2的酸性
用化学用语表示H2O2显酸性的原因______ 。
②H2O2的还原性
某实验用量筒量取浓H2O2溶液配制 溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有
溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有______ 。现用 酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:
酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:______ ,标定的H2O2溶液浓度为______  。
。
③若滴定时出现以下情况,将导致测定结果偏高的是______ 。
A.装入标准酸性KMnO4溶液时,未润洗滴定管
B.滴入最后半滴标准液出现颜色变化就立即停止滴定
C.滴定前盛标准液的滴定管尖嘴处有气泡,滴定后气泡消失
D.记录标准液体积时,滴定前仰视读数,滴定后俯视读数
【查阅资料】
①Na2O2与水反应先生成H2O2,然后H2O2分解;
②H2O2类似于二元弱酸,
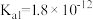 ,且具有强氧化性;
,且具有强氧化性;③酚酞在
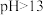 的溶液中变为无色。
的溶液中变为无色。
(1)探究一:褪色原因
【提出猜想】
假设一:反应产生的O2将酚酞氧化;
假设二:反应产生的H2O2将酚酞氧化;
假设三:NaOH溶液浓度过高导致酚酞试液褪色。
实验如下表,请填写空白:
| 实验编号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 在5mLpH=10的NaOH溶液中滴加5滴酚酞试液,再通入足量O2 | 溶液变红后不褪色 | 假设一: |
| ② | 在5mLpH=10的NaOH溶液中滴加5滴酚酞试液,再滴加1mL3%的H2O2溶液 | 假设二:成立 | |
| ③ | 在5mL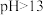 的NaOH溶液中滴加5滴酚酞试液 的NaOH溶液中滴加5滴酚酞试液 | 溶液先变红,后褪色 | 假设三:成立 |
【提出猜想】
(2)针对假设二,有同学提出还应补充实验才能证明Na2O2与水反应生成了 H2O2,则补充的实验操作为:
(3)探究二:H2O2的性质及应用
①H2O2的酸性
用化学用语表示H2O2显酸性的原因
②H2O2的还原性
某实验用量筒量取浓H2O2溶液配制
 溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有
溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有 酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:
酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为: 。
。③若滴定时出现以下情况,将导致测定结果偏高的是
A.装入标准酸性KMnO4溶液时,未润洗滴定管
B.滴入最后半滴标准液出现颜色变化就立即停止滴定
C.滴定前盛标准液的滴定管尖嘴处有气泡,滴定后气泡消失
D.记录标准液体积时,滴定前仰视读数,滴定后俯视读数
您最近一年使用:0次
2 . 过氧化钙( )常用作种子及谷物的消毒剂。
)常用作种子及谷物的消毒剂。
已知: 微溶于水,可与水、酸反应生成氧气。
微溶于水,可与水、酸反应生成氧气。
回答下列问题:
(1) 与水反应的化学方程式为
与水反应的化学方程式为___________ 。
(2)实验室可用图甲所示装置制备过氧化钙。

①仪器a的名称是___________ 。
②碱石灰的作用是___________ 。
(3)利用反应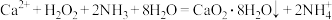 制取
制取 的装置如图乙所示。
的装置如图乙所示。
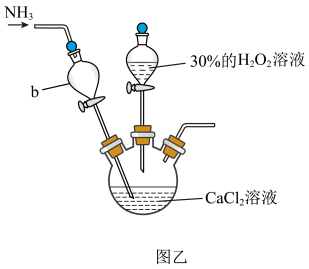
①该反应需控制温度在5℃以下,可采用的降温措施是___________ 。
②反应后,从混合物中分离得到 晶体的操作是
晶体的操作是___________ 。
③仪器b除导气作用外,还具有___________ 的作用。
 )常用作种子及谷物的消毒剂。
)常用作种子及谷物的消毒剂。已知:
 微溶于水,可与水、酸反应生成氧气。
微溶于水,可与水、酸反应生成氧气。回答下列问题:
(1)
 与水反应的化学方程式为
与水反应的化学方程式为(2)实验室可用图甲所示装置制备过氧化钙。

①仪器a的名称是
②碱石灰的作用是
(3)利用反应
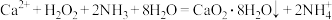 制取
制取 的装置如图乙所示。
的装置如图乙所示。
①该反应需控制温度在5℃以下,可采用的降温措施是
②反应后,从混合物中分离得到
 晶体的操作是
晶体的操作是③仪器b除导气作用外,还具有
您最近一年使用:0次
解题方法
3 . 某实验小组同学,就实验室存放的 是否变质的问题,展开了如下的实验探究。
是否变质的问题,展开了如下的实验探究。
(1)提出问题: 必须密封保存,因为它能与空气中的
必须密封保存,因为它能与空气中的______ 、______ (均填化学式)发生反应而变质,生成 的反应方程式为
的反应方程式为____________ 。
(2)猜想假设:a. 未变质;b.
未变质;b. 已全部变质;c.
已全部变质;c.______ (补充完猜想)。
(3)设计实验:①取适量药品于试管中,加蒸馏水使固体全部溶解;步骤②③如图所示。

现象与结论:若观察到步骤③中____________ ,则推断上述猜想a合理;若观察到____________ ,则推断上述猜想b合理;综合两方面现象可推断c是否合理。
 是否变质的问题,展开了如下的实验探究。
是否变质的问题,展开了如下的实验探究。(1)提出问题:
 必须密封保存,因为它能与空气中的
必须密封保存,因为它能与空气中的 的反应方程式为
的反应方程式为(2)猜想假设:a.
 未变质;b.
未变质;b. 已全部变质;c.
已全部变质;c.(3)设计实验:①取适量药品于试管中,加蒸馏水使固体全部溶解;步骤②③如图所示。

现象与结论:若观察到步骤③中
您最近一年使用:0次
名校
解题方法
4 . 钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
(1) 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:

①生成 的化学方程式是
的化学方程式是______ 。
② 样品加水溶解的化学方程式为
样品加水溶解的化学方程式为______ ,生成标准状况下33.6 L气体,转移电子数为______ 。
③样液中加入 后产生能使带火星木条复燃的气体,说明
后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成了
与水反应的过程中还生成了______ (化学式)。
④滤液中加入 溶液产生白色沉淀,说明
溶液产生白色沉淀,说明 样品中含有
样品中含有______ 杂质,生成白色沉淀的离子方程式是______ 。
(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠( ,能溶于水)的工艺流程如图:
,能溶于水)的工艺流程如图:
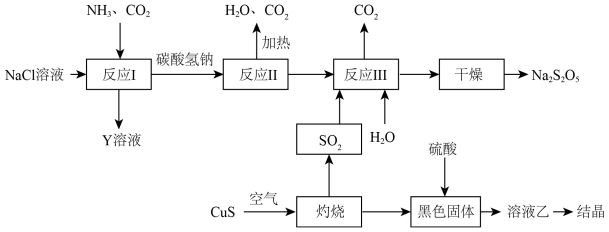
①反应I反应的化学方程式是______ 。
②关于该流程,下列说法正确的是______ (填字母)
a.反应反应I中应先通入 ,再通入
,再通入
b.反应II属于氧化还原反应
c.该流程中, 可以循环使用
可以循环使用
d.溶液乙的结晶产物是硫酸铜晶体
③反应III包含多步反应:
第一步:……
第二步: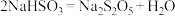
为了减少产品 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为______ 。
(3)已知 与稀硫酸反应生成
与稀硫酸反应生成 ,其离子方程式为
,其离子方程式为______ 。
(1)
 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:
①生成
 的化学方程式是
的化学方程式是②
 样品加水溶解的化学方程式为
样品加水溶解的化学方程式为③样液中加入
 后产生能使带火星木条复燃的气体,说明
后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成了
与水反应的过程中还生成了④滤液中加入
 溶液产生白色沉淀,说明
溶液产生白色沉淀,说明 样品中含有
样品中含有(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠(
 ,能溶于水)的工艺流程如图:
,能溶于水)的工艺流程如图:
①反应I反应的化学方程式是
②关于该流程,下列说法正确的是
a.反应反应I中应先通入
 ,再通入
,再通入
b.反应II属于氧化还原反应
c.该流程中,
 可以循环使用
可以循环使用d.溶液乙的结晶产物是硫酸铜晶体
③反应III包含多步反应:
第一步:……
第二步:
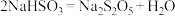
为了减少产品
 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为(3)已知
 与稀硫酸反应生成
与稀硫酸反应生成 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2023-02-09更新
|
876次组卷
|
3卷引用:四川省成都市第七中学2022-2023学年高一上学期期末考试化学试题
5 . 已知A为淡黄色固体,M、N为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体。

(1)写出下列物质的化学式:A______ ;G_______ 。
(2)写出下列反应方程式:
D与盐酸反应的离子方程式______ ;
H在潮湿空气中变成I的化学方程式______ 。
(3)某同学取少量J溶液于试管中,滴加酸性高锰酸钾溶液,振荡后溶液紫色消失,该同学由此得出结论:J溶液中含有Fe2+。该结论是否严谨?___________ (填“是”或“否”),理由是_________________ 。
(4)与D物质组成元素相同的另外两种常见氧化物是红棕色粉末(X)_____ (填化学式,下同)和黑色粉末(Y)_______ 。质量比为29∶20∶36的D、X、Y的氧原子个数之比为_______ 。

(1)写出下列物质的化学式:A
(2)写出下列反应方程式:
D与盐酸反应的离子方程式
H在潮湿空气中变成I的化学方程式
(3)某同学取少量J溶液于试管中,滴加酸性高锰酸钾溶液,振荡后溶液紫色消失,该同学由此得出结论:J溶液中含有Fe2+。该结论是否严谨?
(4)与D物质组成元素相同的另外两种常见氧化物是红棕色粉末(X)
您最近一年使用:0次
6 . 为验证氧化钠与水的反应,某学习小组设计了如图所示的装置(夹持仪器已略去)并进行实验。

请回答下列问题:
(1)仪器a的名称为___________ 。
(2)装置C中可观察到的实验现象为___________ 。
(3)装置A中发生反应的化学方程式为___________ 。

请回答下列问题:
(1)仪器a的名称为
(2)装置C中可观察到的实验现象为
(3)装置A中发生反应的化学方程式为
您最近一年使用:0次
2020-12-18更新
|
679次组卷
|
4卷引用:四川省内江市2021-2022学年高一下学期期末检测文科化学试题
名校
7 . X、Y、Z、R、W为五种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常做耐高温材料。回答下列问题:
(1)Y元素的名称______ ,在周期表中的位于第三周期__________ 族
(2)W与Z单质化合得到的物质属于__________ 化合物(选填“离子”或“共价”),向其溶液中加入足量NaOH溶液,反应的离子方程式为______ 。
(3)工业上常用W单质与氨气在1700℃发生置换反应,生成一种最轻的气体和一种坚硬耐磨的固体,试写出该反应的化学方程式_________________________ 。
(4)化合物甲由元素X、R组成,甲能与水剧烈反应,并产生大量气泡,写出其化学反应方程式______ ,甲的电子式为_____________ 。
(5)为比较元素X和Y的非金属性强弱,下列方法不可行的是___ 。
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(1)Y元素的名称
(2)W与Z单质化合得到的物质属于
(3)工业上常用W单质与氨气在1700℃发生置换反应,生成一种最轻的气体和一种坚硬耐磨的固体,试写出该反应的化学方程式
(4)化合物甲由元素X、R组成,甲能与水剧烈反应,并产生大量气泡,写出其化学反应方程式
(5)为比较元素X和Y的非金属性强弱,下列方法不可行的是
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
您最近一年使用:0次
2017-07-04更新
|
351次组卷
|
5卷引用:四川省简阳市2016-2017学年高一下学期期末考试化学试题



