解题方法
1 . 过氧化钠可用于医药、印染、漂白等。某学习兴趣小组探究Na2O2与NO2、NO的反应,设计如图所示实验。

(1)盛放浓硝酸的仪器M名称为_________ ,A中发生反应的离子方程式为________ 。
(2)Na2O2与NO2反应,根据化合价升降原则有下列两种观点。
观点一:Na2O2氧化NO2,生成NaNO3;
观点二:NO2氧化Na2O2,生成O2。
为验证以上观点的正确性进行如下实验:
①关闭K2和弹簧夹,打开K1和A中仪器M的活塞,再将带火星的木条放在a处,观察到_______ 。甲同学认为观点二正确。
②乙同学认为该装置不能确认观点二正确,应在A、G之间增加一个装置,该装置的作用为______ 。改进后重复甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条没有复燃。判断观点一正确。
(3)丙同学根据NO易与O2反应,预测NO也易与Na2O2反应。
①丙同学关闭K1,打开K2,用上图的装置进行实验,为防止NO与空气中氧气反应,反应前的操作是___________ 。
②装置B的作用为___________ 。
③反应一段时间后,取D装置中产物少许,加入稀硫酸,产生无色气体遇到空气变为红棕色。完成反应的化学方程式:___________ 。
6___________ 4___________
4___________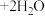
④根据D装置中产物的判断结果,说明Na2O2与NO反应中Na2O2的作用是___________ 。(填标号)
A.氧化剂 B.还原剂 C.即是氧化剂也是还原剂

(1)盛放浓硝酸的仪器M名称为
(2)Na2O2与NO2反应,根据化合价升降原则有下列两种观点。
观点一:Na2O2氧化NO2,生成NaNO3;
观点二:NO2氧化Na2O2,生成O2。
为验证以上观点的正确性进行如下实验:
①关闭K2和弹簧夹,打开K1和A中仪器M的活塞,再将带火星的木条放在a处,观察到
②乙同学认为该装置不能确认观点二正确,应在A、G之间增加一个装置,该装置的作用为
(3)丙同学根据NO易与O2反应,预测NO也易与Na2O2反应。
①丙同学关闭K1,打开K2,用上图的装置进行实验,为防止NO与空气中氧气反应,反应前的操作是
②装置B的作用为
③反应一段时间后,取D装置中产物少许,加入稀硫酸,产生无色气体遇到空气变为红棕色。完成反应的化学方程式:
6___________
 4___________
4___________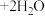
④根据D装置中产物的判断结果,说明Na2O2与NO反应中Na2O2的作用是
A.氧化剂 B.还原剂 C.即是氧化剂也是还原剂
您最近一年使用:0次
名校
2 . 过氧化钠是重要的化工原料,具有杀菌、消毒等多种用途,请回答下列问题:
(1) 在空气中易变质,写出
在空气中易变质,写出 与
与 反应的化学方程式:
反应的化学方程式:______
(2)若将 投入到含有下列离子的溶液中:
投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有______ (填离子符号)。
(3) 因保存不当易吸收空气中的
因保存不当易吸收空气中的 ,实验小组取样品m g,设计如图实验装置测定样品中
,实验小组取样品m g,设计如图实验装置测定样品中 的质量分数;
的质量分数;
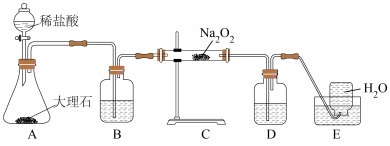
①将实验装置组装好后,必须进行的第一步操作是______ ;装置D中的试剂:______ ;
②反应结束后,测得生成气体的体积为V L(已折算为标准状况下的体积),则样品中 的质量分数为
的质量分数为______ 。
(1)
 在空气中易变质,写出
在空气中易变质,写出 与
与 反应的化学方程式:
反应的化学方程式:(2)若将
 投入到含有下列离子的溶液中:
投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有(3)
 因保存不当易吸收空气中的
因保存不当易吸收空气中的 ,实验小组取样品m g,设计如图实验装置测定样品中
,实验小组取样品m g,设计如图实验装置测定样品中 的质量分数;
的质量分数;
①将实验装置组装好后,必须进行的第一步操作是
②反应结束后,测得生成气体的体积为V L(已折算为标准状况下的体积),则样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-12-01更新
|
80次组卷
|
2卷引用:山东省聊城市2023-2024学年高一上学期11月期中化学试题
名校
3 . SO2虽是大气污染物之一,但也是重要的工业原料。某同学在实验室设计了如下实验,对SO2的部分性质进行了探究。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是_______ (结合有关平衡方程式简要说明)。
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。
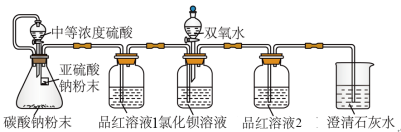
(2)加入碳酸钠粉末的目的是_______ 。
(3)当_______ 时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是_______ 。
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为_______ 。
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若_______ ,说明还原性:SO2>I-,写出该反应的离子方程式:_______ 。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。

(2)加入碳酸钠粉末的目的是
(3)当
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若
您最近一年使用:0次
2022-12-31更新
|
305次组卷
|
2卷引用:广东省梅州市名校2022-2023学年高三上学期期末考试化学试题
名校
4 . 化学实验是研究物质组成和探究物质性质的重要途径。
I.某澄清透明溶液(忽略水的电离),可能含有 、
、 、
、 、
、 、
、 、
、 、
、 等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示:
等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示:

请你根据上述实验推断:
(1)实验③产生的无色无味气体为_______ 、白色沉淀为_______ 。(填物质化学式)
(2)原溶液中一定存在的离子有_______ ,一定不存在的离子有_______ 。
(3)向该溶液中加入硫酸酸化,再通入 气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式(已知该反应中氧化剂和还原剂的个数比为2∶5):
气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式(已知该反应中氧化剂和还原剂的个数比为2∶5):_______ 。
II. 具有强氧化性,
具有强氧化性, 具有还原性,某同学根据氧化还原反应的知识推测
具有还原性,某同学根据氧化还原反应的知识推测 与
与 能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A中用锌和稀盐酸制取氢气。
能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A中用锌和稀盐酸制取氢气。

(4)装置B的名称_______ ,作用是_______ 。
(5)下面是实验过程中的重要操作,正确的顺序是_______。
(6)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推测出 与
与 反应生成的产物为
反应生成的产物为_______ 。
I.某澄清透明溶液(忽略水的电离),可能含有
 、
、 、
、 、
、 、
、 、
、 、
、 等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示:
等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示:
请你根据上述实验推断:
(1)实验③产生的无色无味气体为
(2)原溶液中一定存在的离子有
(3)向该溶液中加入硫酸酸化,再通入
 气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式(已知该反应中氧化剂和还原剂的个数比为2∶5):
气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式(已知该反应中氧化剂和还原剂的个数比为2∶5):II.
 具有强氧化性,
具有强氧化性, 具有还原性,某同学根据氧化还原反应的知识推测
具有还原性,某同学根据氧化还原反应的知识推测 与
与 能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A中用锌和稀盐酸制取氢气。
能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A中用锌和稀盐酸制取氢气。
(4)装置B的名称
(5)下面是实验过程中的重要操作,正确的顺序是_______。
A.加热至 逐渐熔化,反应一段时间 逐渐熔化,反应一段时间 | B.用小试管收集气体并检验其纯度 |
C.打开 、 、 ,通入氢气 ,通入氢气 | D.停止加热,充分冷却,关闭 、 、 |
 与
与 反应生成的产物为
反应生成的产物为
您最近一年使用:0次
2022-10-12更新
|
590次组卷
|
3卷引用:辽宁省实验中学2022-2023学年高一上学期10月月考化学试题
5 . 研究小组探究Na2O2与水反应。向1.56gNa2O2粉末中加入40mL水,充分反应得溶液A(溶液体积变化忽略不计),进行实验。
实验1:向2mL溶液A中滴入1滴酚酞,溶液变红色,20秒后褪色。
(1)Na2O2与H2O反应的化学方程式为___ 。溶液A中NaOH溶液的物质的量浓度为___ 。
(2)对实验1中溶液红色褪去的原因进行探究。
【查阅资料】
资料:H2O2是一种在碱性条件下不稳定、具有漂白性的物质。
【提出猜想】
猜想1:Na2O2与H2O反应可能生成了H2O2
猜想2:生成的NaOH浓度太大
【设计并进行实验】
①实验2:向2mL溶液A中加入黑色粉末___ (填化学式),快速产生了能使带火星木条复燃的气体。
②实验3:向2mL物质的量浓度为___ mol/LNaOH溶液中滴入1滴酚酞,溶液变红色,10分钟后溶液褪色。向褪色的溶液中加入___ ,溶液变红色。
【得出结论】
③由以上实验可得出的结论是___ 。
【反思与评价】
(3)分析实验结果可知,Na2O2与H2O反应的化学方程式如果分两步书写,应为___ 、___ ,但课本上没有写出中间产物H2O2,可能的原因是___ 。
实验1:向2mL溶液A中滴入1滴酚酞,溶液变红色,20秒后褪色。
(1)Na2O2与H2O反应的化学方程式为
(2)对实验1中溶液红色褪去的原因进行探究。
【查阅资料】
资料:H2O2是一种在碱性条件下不稳定、具有漂白性的物质。
【提出猜想】
猜想1:Na2O2与H2O反应可能生成了H2O2
猜想2:生成的NaOH浓度太大
【设计并进行实验】
①实验2:向2mL溶液A中加入黑色粉末
②实验3:向2mL物质的量浓度为
【得出结论】
③由以上实验可得出的结论是
【反思与评价】
(3)分析实验结果可知,Na2O2与H2O反应的化学方程式如果分两步书写,应为
您最近一年使用:0次
解题方法
6 . 单质B是空气的主要成分之一,金属单质A与B在加热时生成淡黄色固体C,D是一种无色无味的气体,能使澄清石灰水变浑浊,常温下E为液体,完成下列问题:

(1)A与B在加热时所产生的火焰颜色为___________ 色,工业上冶炼A的方法是___________ ;
(2)C的化学式为___________ ,写出C的任意一种用途:___________ ;
(3)D的名称为___________ ;
(4)F与过量的D生成H的化学反应方程式为:___________ ;
(5)向G的溶液中加入氯化钡溶液___________ (填“能”或“不能”)产生沉淀。

(1)A与B在加热时所产生的火焰颜色为
(2)C的化学式为
(3)D的名称为
(4)F与过量的D生成H的化学反应方程式为:
(5)向G的溶液中加入氯化钡溶液
您最近一年使用:0次



