名校
解题方法
1 . 食品工业经常使用 和
和 作膨松剂
作膨松剂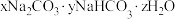 。室温下,向含3.07g某膨松剂试样的溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随
。室温下,向含3.07g某膨松剂试样的溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随 变化的图象如图所示。
变化的图象如图所示。 点溶液溶质的主要成分的化学式为
点溶液溶质的主要成分的化学式为___________ ;图中A点n(Na2CO3)=___________ mol。
(2)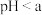 时发生反应的离子反应方程式为
时发生反应的离子反应方程式为___________ 。x:y:z=___________ 。
 和
和 作膨松剂
作膨松剂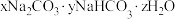 。室温下,向含3.07g某膨松剂试样的溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随
。室温下,向含3.07g某膨松剂试样的溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随 变化的图象如图所示。
变化的图象如图所示。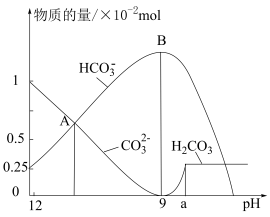
 点溶液溶质的主要成分的化学式为
点溶液溶质的主要成分的化学式为(2)
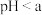 时发生反应的离子反应方程式为
时发生反应的离子反应方程式为
您最近一年使用:0次
2 . 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有 颗粒的装置,它的用途是产生氧气。
颗粒的装置,它的用途是产生氧气。
(1)下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是___________。
(2)写出 的电子式
的电子式___________ ,其晶体中存在的化学键类型是___________ 。
(3)下列关于 的叙述正确的是___________。
的叙述正确的是___________。
(4) 可用氢氧化钠溶液吸收,若将0.01mol的
可用氢氧化钠溶液吸收,若将0.01mol的 通入0.03mol的氢氧化钠溶液中,充分反应后,溶液中的溶质为
通入0.03mol的氢氧化钠溶液中,充分反应后,溶液中的溶质为___________ (写化学式)
(5)向(4)中反应后的溶液中逐滴加入0.1mol/L的盐酸,并及时振荡,以下哪张图符合产生的气体体积 与加入盐酸的体积
与加入盐酸的体积 的关系(其中B、C、D图中分别有
的关系(其中B、C、D图中分别有 、
、 、
、 )___________
)___________
 颗粒的装置,它的用途是产生氧气。
颗粒的装置,它的用途是产生氧气。(1)下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是___________。
A.Na和 | B.NaOH和 | C. 和NaOH 和NaOH | D. 和HCl 和HCl |
 的电子式
的电子式(3)下列关于
 的叙述正确的是___________。
的叙述正确的是___________。A. 中正、负离子的个数比为1∶1 中正、负离子的个数比为1∶1 |
B. 分别与水及 分别与水及 反应产生相同量的 反应产生相同量的 时,需要水和 时,需要水和 的质量相等 的质量相等 |
C. 分别与水及 分别与水及 反应产生相同量的 反应产生相同量的 时,转移电子的物质的量相等 时,转移电子的物质的量相等 |
D. 的漂白原理与 的漂白原理与 的漂白原理相同 的漂白原理相同 |
 可用氢氧化钠溶液吸收,若将0.01mol的
可用氢氧化钠溶液吸收,若将0.01mol的 通入0.03mol的氢氧化钠溶液中,充分反应后,溶液中的溶质为
通入0.03mol的氢氧化钠溶液中,充分反应后,溶液中的溶质为(5)向(4)中反应后的溶液中逐滴加入0.1mol/L的盐酸,并及时振荡,以下哪张图符合产生的气体体积
 与加入盐酸的体积
与加入盐酸的体积 的关系(其中B、C、D图中分别有
的关系(其中B、C、D图中分别有 、
、 、
、 )___________
)___________A. | B. |
C. | D. |
您最近一年使用:0次
解题方法
3 . 回答下列问题:
(1)纯碱的化学式为_______ 。
(2)化学家舍勒将软锰矿与浓盐酸混合加热,制得了氯气。软锰矿的主要成分为_______ (写化学式)。
(3)鉴别AgCl和Ag2CO3所用试剂为_______ ,写出反应的离子方程式_______ 。
(4)在钢铁厂,需要注入铁水的模具必须进行充分干燥处理,不得留有水,请用化学方程式解释其原因_______ 。
(1)纯碱的化学式为
(2)化学家舍勒将软锰矿与浓盐酸混合加热,制得了氯气。软锰矿的主要成分为
(3)鉴别AgCl和Ag2CO3所用试剂为
(4)在钢铁厂,需要注入铁水的模具必须进行充分干燥处理,不得留有水,请用化学方程式解释其原因
您最近一年使用:0次
2022-11-11更新
|
143次组卷
|
2卷引用:浙江省衢温“5+1”联盟2022-2023学年高一上学期期中联考化学试题
解题方法
4 . 碳酸钠(Na2CO3)
(1)碳酸钠是白色固体,俗称_______ ,_______ 于水;电离方程式_______ 。
(2)实验探究-Na2CO3的性质
(3)Na2CO3溶液与酸的反应
①与足量盐酸反应:_______
②通入足量CO2:_______
(1)碳酸钠是白色固体,俗称
(2)实验探究-Na2CO3的性质
| 实验 | 现象 | 结论(或化学方程式) |
| 将澄清石灰水加入碳酸钠溶液中 | ||
| 将氯化钙溶液加入碳酸钠溶液中 | ||
| 测碳酸钠溶液pH | pH | 碳酸钠溶液呈 |
| 将沾有油污的铜片放入热的碳酸钠溶液中 | 碳酸钠溶液具有 |
①与足量盐酸反应:
②通入足量CO2:
您最近一年使用:0次
2022-08-17更新
|
292次组卷
|
2卷引用:课前-3.2.2 碳酸钠、碳酸氢钠-苏教版2020必修第一册
5 . 某化学兴趣小组对钠及其化合物进行了深度探究。
Ⅰ.“钠在空气中燃烧”实验深度探究
(1)Na在空气中燃烧主要产物是___________ (填化学式)。
(2)钠在空气中燃烧后生成的固体粉末中还含有黑色固体物质。通过查阅文献发现,有一种观点认为该黑色固体物质是C和铁的氧化物。
ⅰ.生成C的原因是CO2和Na在加热条件发生如下反应,请配平该化学方程式,并用单线桥表示出电子转移的方向和数目:___________
___________CO2+___________Na=___________ Na2CO3+___________C
ⅱ.产生铁的氧化物的原因是Na单质中含有0.002%左右的铁元素,在钠燃烧的时候铁被氧化为铁的氧化物。为了检验黑色固体物质中是否含有铁元素,进行了如下实验:
Ⅱ.“纯碱和小苏打”性质实验的深度探究
该组同学利用下图对“碳酸钠溶液与盐酸反应”进行探究

(3)导管P的作用是___________ 。
(4)开始实验;
ⅰ.广口瓶中预先盛放10 mL 1 mol/L的Na2CO3溶液,将分液漏斗中10 mL 1 mol/L的HCl溶液缓缓滴入到广口瓶中,观察到的现象是___________ ,在分液漏斗再加10 mL 1 mol/L的HCl溶液并滴入广口瓶,发生反应的离子方程式为___________ 。
ⅱ.广口瓶中预先盛放10 mL 1 mol/L的HCl溶液,将分液漏斗中的10 mL 1 mol/L Na2CO3溶液中的5 mL溶液快速滴入到广口瓶中,立刻有大量气泡产生,气球膨胀。再将剩余的5 mL 1 mol/L的Na2CO3溶液加入到广口瓶中,几分钟后,气球变扁,变扁的原因是___________ (用化学方程式作答)。
(5)实验结论:
a.Na2CO3与盐酸反应是分步进行的;
b.碳酸钠和碳酸氢钠在一定条件下可以相互转化;
c. 和
和 中结合H+能力较强的是
中结合H+能力较强的是___________ (填离子符号)。
Ⅰ.“钠在空气中燃烧”实验深度探究
(1)Na在空气中燃烧主要产物是
(2)钠在空气中燃烧后生成的固体粉末中还含有黑色固体物质。通过查阅文献发现,有一种观点认为该黑色固体物质是C和铁的氧化物。
ⅰ.生成C的原因是CO2和Na在加热条件发生如下反应,请配平该化学方程式,并用单线桥表示出电子转移的方向和数目:
___________CO2+___________Na=___________ Na2CO3+___________C
ⅱ.产生铁的氧化物的原因是Na单质中含有0.002%左右的铁元素,在钠燃烧的时候铁被氧化为铁的氧化物。为了检验黑色固体物质中是否含有铁元素,进行了如下实验:
| 实验内容 | 实验现象 | 实验结论 |
| ①收集黑色固体物质溶于稀硫酸中 | 少量黑色固体物质不溶解 | |
| ②取上层清液少许于一支试管中,滴入KSCN溶液 | 溶液变为红色 |
Ⅱ.“纯碱和小苏打”性质实验的深度探究
该组同学利用下图对“碳酸钠溶液与盐酸反应”进行探究

(3)导管P的作用是
(4)开始实验;
ⅰ.广口瓶中预先盛放10 mL 1 mol/L的Na2CO3溶液,将分液漏斗中10 mL 1 mol/L的HCl溶液缓缓滴入到广口瓶中,观察到的现象是
ⅱ.广口瓶中预先盛放10 mL 1 mol/L的HCl溶液,将分液漏斗中的10 mL 1 mol/L Na2CO3溶液中的5 mL溶液快速滴入到广口瓶中,立刻有大量气泡产生,气球膨胀。再将剩余的5 mL 1 mol/L的Na2CO3溶液加入到广口瓶中,几分钟后,气球变扁,变扁的原因是
(5)实验结论:
a.Na2CO3与盐酸反应是分步进行的;
b.碳酸钠和碳酸氢钠在一定条件下可以相互转化;
c.
 和
和 中结合H+能力较强的是
中结合H+能力较强的是
您最近一年使用:0次
解题方法
6 . 我国著名化学家侯德榜发明的“联合制碱法”的反应原理用化学方程式可简要表示为:
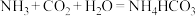 ,
,
 ;
;
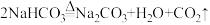 。
。
(1)纯碱属于___________ (填“酸”“碱”或“盐”)。
(2)检验碳酸氢钠中含有碳酸钠的方法是___________ 。
(3) ,请写出该反应能发生的原因
,请写出该反应能发生的原因_________ 。
(4)向含有碳酸钠和碳酸氢钠的溶液中逐滴滴加1 mol/L盐酸,产生标准状况下气体的体积与盐酸体积关系如图所示:
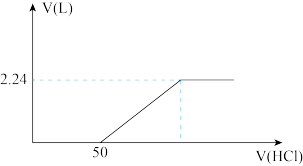
①逐滴滴加盐酸的过程中 物质的量变化趋势是
物质的量变化趋势是___________ ;
②上述混合溶液碳酸氢钠的物质的量是___________ 。
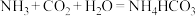 ,
, ;
;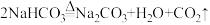 。
。(1)纯碱属于
(2)检验碳酸氢钠中含有碳酸钠的方法是
(3)
 ,请写出该反应能发生的原因
,请写出该反应能发生的原因(4)向含有碳酸钠和碳酸氢钠的溶液中逐滴滴加1 mol/L盐酸,产生标准状况下气体的体积与盐酸体积关系如图所示:

①逐滴滴加盐酸的过程中
 物质的量变化趋势是
物质的量变化趋势是②上述混合溶液碳酸氢钠的物质的量是
您最近一年使用:0次
2021-12-23更新
|
1279次组卷
|
4卷引用:广西河池市八校2021-2022学年高一上学期第二次联考化学试题
广西河池市八校2021-2022学年高一上学期第二次联考化学试题(已下线)专题36 碳酸钠质量分数测定的实验探究-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)第二章《 海水中的重要元素----钠和氯》基础过关单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)天津市外国语大学附属外国语学校2022~2023学年高一上学期阶段性检测化学试题
7 . 某学生用Na2CO3和NaHCO3组成的均匀混合物进行以下实验。(气体体积已折算成标准状况下的体积,不考虑CO2在水中的溶解,不考虑HCl的挥发)
实验1:取2.96 g固体混合物加入质量分数为12.0%,密度为1.065 g/cm3的盐酸40 mL,共产生672 mL气体。
实验2:取8.88 g该固体化合物逐滴加入40 mL该盐酸,则产生a mL的气体。
(1)盐酸的物质的量浓度c(HCl)=___________ (保留两位小数)。
(2)样品中物质的量之比n(Na2CO3):n(NaHCO3)=___________ 。
(3)a=___________ mL。
实验1:取2.96 g固体混合物加入质量分数为12.0%,密度为1.065 g/cm3的盐酸40 mL,共产生672 mL气体。
实验2:取8.88 g该固体化合物逐滴加入40 mL该盐酸,则产生a mL的气体。
(1)盐酸的物质的量浓度c(HCl)=
(2)样品中物质的量之比n(Na2CO3):n(NaHCO3)=
(3)a=
您最近一年使用:0次
名校
解题方法
8 . 现有一定量硫酸钠和碳酸钠固体混合物,加入足量的氯化钡溶液使其完全反应,得到沉淀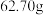 ,再向沉淀中加入足量盐酸,充分反应后沉淀减少到
,再向沉淀中加入足量盐酸,充分反应后沉淀减少到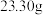 ,并产生一定量的二氧化碳气体。(写出详细的解题过程,结果保留2位有效数字)。求:
,并产生一定量的二氧化碳气体。(写出详细的解题过程,结果保留2位有效数字)。求:
(1)原固体混合物中硫酸钠的质量分数是 1 。
(2)标准状况下,产生二氧化碳的体积是 2 。
(3)若盐酸的质分数为36.5%,密度为 ,产生上述体积的二氧化碳消耗盐酸的体积为
,产生上述体积的二氧化碳消耗盐酸的体积为 3 。
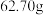 ,再向沉淀中加入足量盐酸,充分反应后沉淀减少到
,再向沉淀中加入足量盐酸,充分反应后沉淀减少到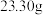 ,并产生一定量的二氧化碳气体。(写出详细的解题过程,结果保留2位有效数字)。求:
,并产生一定量的二氧化碳气体。(写出详细的解题过程,结果保留2位有效数字)。求:(1)原固体混合物中硫酸钠的质量分数是
(2)标准状况下,产生二氧化碳的体积是
(3)若盐酸的质分数为36.5%,密度为
 ,产生上述体积的二氧化碳消耗盐酸的体积为
,产生上述体积的二氧化碳消耗盐酸的体积为
您最近一年使用:0次
20-21高一下·浙江·阶段练习
解题方法
9 . (1)①写出52号元素在元素周期表中的位置___ 。
②用电子式表示MgCl2的形成过程___ 。
(2)现在需配制0.1mol/L的Na2CO3溶液480mL,需要用托盘天平称量Na2CO3固体__ g。
(3)写出碳酸钠溶液和过量盐酸反应的离子方程式___ 。
②用电子式表示MgCl2的形成过程
(2)现在需配制0.1mol/L的Na2CO3溶液480mL,需要用托盘天平称量Na2CO3固体
(3)写出碳酸钠溶液和过量盐酸反应的离子方程式
您最近一年使用:0次



