1 . 阅读下面一段材料并回答问题。
 俗称纯碱,通常为白色粉末,易溶于水,热稳定性较强,但高温下也可以分解为
俗称纯碱,通常为白色粉末,易溶于水,热稳定性较强,但高温下也可以分解为  和
和  。
。

 有着广泛的用途。高温下可与石英砂
有着广泛的用途。高温下可与石英砂 反应生产玻璃。也可用于烟气脱硫,
反应生产玻璃。也可用于烟气脱硫, 水溶液吸收
水溶液吸收  ,再通入空气,最终可得到
,再通入空气,最终可得到  和
和 。在冶金工业中也可以与
。在冶金工业中也可以与  等金属硫化物反应,生成
等金属硫化物反应,生成 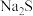 、
、 和
和  等金属氧化物。在食品工业、国防、医药等领域亦有广泛应用。
等金属氧化物。在食品工业、国防、医药等领域亦有广泛应用。
工业上有多种制备 的方法。我国化学家侯德榜先生提出了氨碱法制取
的方法。我国化学家侯德榜先生提出了氨碱法制取  和合成氨联合起来生产的工艺,可同时获得
和合成氨联合起来生产的工艺,可同时获得  和
和 两种物质,再煅烧
两种物质,再煅烧  获得
获得  ,原盐的利用率也得到了提升。侯氏制碱法对我国纯碱工业和国民经济发展做出了巨大贡献。
,原盐的利用率也得到了提升。侯氏制碱法对我国纯碱工业和国民经济发展做出了巨大贡献。
(1)根据 的性质可知它属于
的性质可知它属于___________ 类(填字母)。
a.酸 b.碱 c.盐
(2) 用于烟气脱硫发生反应的离子方程式是
用于烟气脱硫发生反应的离子方程式是___________ 。
(3)判断下列说法是否正确(填“对”或“错”)
a. 和
和  受热均易分解。
受热均易分解。___________
b. 与
与  的反应不是氧化还原反应。
的反应不是氧化还原反应。___________
c.侯氏制碱法除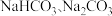 外还能获得
外还能获得  。
。___________
 俗称纯碱,通常为白色粉末,易溶于水,热稳定性较强,但高温下也可以分解为
俗称纯碱,通常为白色粉末,易溶于水,热稳定性较强,但高温下也可以分解为  和
和  。
。
 有着广泛的用途。高温下可与石英砂
有着广泛的用途。高温下可与石英砂 反应生产玻璃。也可用于烟气脱硫,
反应生产玻璃。也可用于烟气脱硫, 水溶液吸收
水溶液吸收  ,再通入空气,最终可得到
,再通入空气,最终可得到  和
和 。在冶金工业中也可以与
。在冶金工业中也可以与  等金属硫化物反应,生成
等金属硫化物反应,生成 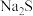 、
、 和
和  等金属氧化物。在食品工业、国防、医药等领域亦有广泛应用。
等金属氧化物。在食品工业、国防、医药等领域亦有广泛应用。工业上有多种制备
 的方法。我国化学家侯德榜先生提出了氨碱法制取
的方法。我国化学家侯德榜先生提出了氨碱法制取  和合成氨联合起来生产的工艺,可同时获得
和合成氨联合起来生产的工艺,可同时获得  和
和 两种物质,再煅烧
两种物质,再煅烧  获得
获得  ,原盐的利用率也得到了提升。侯氏制碱法对我国纯碱工业和国民经济发展做出了巨大贡献。
,原盐的利用率也得到了提升。侯氏制碱法对我国纯碱工业和国民经济发展做出了巨大贡献。(1)根据
 的性质可知它属于
的性质可知它属于a.酸 b.碱 c.盐
(2)
 用于烟气脱硫发生反应的离子方程式是
用于烟气脱硫发生反应的离子方程式是(3)判断下列说法是否正确(填“对”或“错”)
a.
 和
和  受热均易分解。
受热均易分解。b.
 与
与  的反应不是氧化还原反应。
的反应不是氧化还原反应。c.侯氏制碱法除
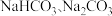 外还能获得
外还能获得  。
。
您最近一年使用:0次
名校
2 . 为对比Na2CO3和NaHCO3的性质,某同学进行如下实验,补全下表。
| 实验装置及操作 |  |  |  |
| 实验现象 | 盛有 | 盛有Na2CO3的试管中固体完全溶解;盛有NaHCO3的试管中固体有剩余 | |
| 实验结论或解释 | 相同温度下,溶解度Na2CO3 | Na2CO3很稳定,受热不易分解; NaHCO3不稳定,受热易分解,分解的化学方程式为 |
您最近一年使用:0次
名校
3 . Na元素相关的物质有很多且具有广泛的用途。
(1)氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。粗盐中一般含有CaCl2、MgCl2、CaSO4和MgSO4杂质。从粗盐制得精盐的过程如下:

①试剂Ⅰ是_____ 。
②加入试剂Ⅱ所发生的离子方程式为:_____
③操作a中,未用到的实验仪器是_____
A.蒸发皿 B.玻璃棒 C.漏斗 D.烧杯
④用到操作c的名称为_____ ,操作b不能省略,理由是_____ 。
(2)Na2CO3、NaHCO3走进千家万户,在食品加工方面有着广泛的用途。
①下列关于Na2CO3的认识正确的是_____ 。
A.受热易分解 B.俗称纯碱、苏打 C.可用于制皂 D.可与酸反应
②传统蒸馒头常采用酵头发面,再用Na2CO3调节面团酸度。查阅资料得知,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。等质量的碳酸钠和碳酸氢钠,消耗酸更多的是_____ 。
③若面团发得不好,面团内的气孔少,略有酸味。可不用Na2CO3而用NaHCO3,继续揉面,上锅蒸后也能蒸出松软的馒头。解释NaHCO3的作用_____ 。
(3)某品牌复合膨松剂的说明书如下图所示。其中葡萄糖酸-δ-内酯和淀粉是助剂,其作用是防止膨松剂吸潮结块而失效。焦磷酸二氢二钠的作用是_____ 。

(1)氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。粗盐中一般含有CaCl2、MgCl2、CaSO4和MgSO4杂质。从粗盐制得精盐的过程如下:

①试剂Ⅰ是
②加入试剂Ⅱ所发生的离子方程式为:
③操作a中,未用到的实验仪器是
A.蒸发皿 B.玻璃棒 C.漏斗 D.烧杯
④用到操作c的名称为
(2)Na2CO3、NaHCO3走进千家万户,在食品加工方面有着广泛的用途。
①下列关于Na2CO3的认识正确的是
A.受热易分解 B.俗称纯碱、苏打 C.可用于制皂 D.可与酸反应
②传统蒸馒头常采用酵头发面,再用Na2CO3调节面团酸度。查阅资料得知,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。等质量的碳酸钠和碳酸氢钠,消耗酸更多的是
③若面团发得不好,面团内的气孔少,略有酸味。可不用Na2CO3而用NaHCO3,继续揉面,上锅蒸后也能蒸出松软的馒头。解释NaHCO3的作用
(3)某品牌复合膨松剂的说明书如下图所示。其中葡萄糖酸-δ-内酯和淀粉是助剂,其作用是防止膨松剂吸潮结块而失效。焦磷酸二氢二钠的作用是

您最近一年使用:0次
名校
解题方法
4 . 某小组同学进行Na2CO3和NaHCO3性质的探究,实验如图(夹持装置已略去,气密性已检验)。
(1)实验I,能够证明Na2CO3的热稳定性强于NaHCO3的证据是_______ ,NaHCO3加热分解的化学方程式为_______ 。
(2)实验II,方框内装置中饱和NaHCO3的作用是_______ 。
(3)实验II圆底烧瓶中发生反应的离子方程式为:_______ ,持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:_______ 。
| 实验I | 实验II |
 | 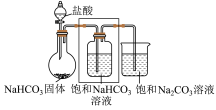 |
(1)实验I,能够证明Na2CO3的热稳定性强于NaHCO3的证据是
(2)实验II,方框内装置中饱和NaHCO3的作用是
(3)实验II圆底烧瓶中发生反应的离子方程式为:
您最近一年使用:0次
名校
解题方法
5 . 某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
(1)KClO4中氯元素的化合价是___________ ,具有___________ (填“还原性”或“氧化性”)。
(2)Fe2O3可处理产生的Na,反应为6Na + Fe2O3 = 3Na2O + 2Fe,反应中Na做___________ (填“还原剂”或“氧化剂”)。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是___________ 。若不用Fe2O3处理产生的Na,Na可与NaHCO3分解产生的水反应,写出Na与水反应的离子方程式___________ 。
(4)按如图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是___________ 。

(5)下列关于Na2CO3和NaHCO3的说法中,正确的是___________ (填字母)。
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
(1)KClO4中氯元素的化合价是
(2)Fe2O3可处理产生的Na,反应为6Na + Fe2O3 = 3Na2O + 2Fe,反应中Na做
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是
(4)按如图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是

(5)下列关于Na2CO3和NaHCO3的说法中,正确的是
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
您最近一年使用:0次
名校
6 . 某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
(1)请帮助该小组同学完成实验报告中的内容。
(2)已知:20℃时Na2CO3的溶解度为20.5g,NaHCO3的溶解度为9.6g;如果向饱和Na2CO3溶液中不断通入CO2气体,有白色晶体析出,化学方程式是___________ 。
(3)由实验⑥可以得出的结论是___________ ,用化学方程式说明得出结论的原___________ 。
(1)请帮助该小组同学完成实验报告中的内容。
| 实验序号 | 实验步骤(内容) | 现象 |
| ① | 在贴有标签a、b的试管中分别加入1.0gNa2CO3固体和NaHCO3固体,观察外观 | |
| ② | 分别滴入几滴水,振荡,摸试管底部。 | 有明显放热现象的试管是 |
| ③ | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象。 | |
| ④ | 再分别向两试管中滴加几滴酚酞溶液,观察现象。 | 溶液均变红,颜色较深的试管是 |
| ⑤ | 最后分别向两溶液中滴加过量的稀盐酸。 | 试管a中反应的离子方程式: |
| ⑥ | 加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末,已知,无水硫酸铜粉末遇水变蓝)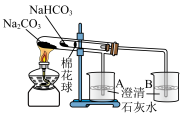 | 在装有NaHCO3固体的装置中的实验现象为: |
(2)已知:20℃时Na2CO3的溶解度为20.5g,NaHCO3的溶解度为9.6g;如果向饱和Na2CO3溶液中不断通入CO2气体,有白色晶体析出,化学方程式是
(3)由实验⑥可以得出的结论是
您最近一年使用:0次
名校
解题方法
7 . 碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式_______ ,俗称_______ ,其水溶液显_______ (填“酸”、“碱”或“中”)性。
(2)碳酸氢钠与盐酸反应的离子方程式为_______ 。等质量的碳酸钠和碳酸氢钠与足量盐酸反应时剧烈程度,前者_______ 后者(填“>”、“<”或“=”)。
(1)碳酸氢钠的化学式
(2)碳酸氢钠与盐酸反应的离子方程式为
您最近一年使用:0次
名校
8 . 实验小组利用传感器探究 和
和 的性质。
的性质。
【查阅资料】pH越小, 浓度越小,溶液碱性越弱。
浓度越小,溶液碱性越弱。
【实验过程】
【分析与解释】
(1)实验Ⅰ中,溶解时吸收热量的物质是______ 。
(2)实验Ⅱ中, 溶液和澄清石灰水反应的离子方程式为
溶液和澄清石灰水反应的离子方程式为______ , 未参与该反应的实验证据是
未参与该反应的实验证据是______ 。
(3)实验Ⅱ中,滴加 溶液的pH变化与滴加
溶液的pH变化与滴加 溶液的有明显差异,原因是滴加
溶液的有明显差异,原因是滴加 溶液的烧杯中,参与反应的离子有
溶液的烧杯中,参与反应的离子有______ 。
 和
和 的性质。
的性质。【查阅资料】pH越小,
 浓度越小,溶液碱性越弱。
浓度越小,溶液碱性越弱。【实验过程】
| 编号 | 实验操作 | 实验数据 |
| 实验Ⅰ | 测量下述实验过程的温度变化 |  |
| 实验Ⅱ | 测量下述实验过程的pH变化 |  |
(1)实验Ⅰ中,溶解时吸收热量的物质是
(2)实验Ⅱ中,
 溶液和澄清石灰水反应的离子方程式为
溶液和澄清石灰水反应的离子方程式为 未参与该反应的实验证据是
未参与该反应的实验证据是(3)实验Ⅱ中,滴加
 溶液的pH变化与滴加
溶液的pH变化与滴加 溶液的有明显差异,原因是滴加
溶液的有明显差异,原因是滴加 溶液的烧杯中,参与反应的离子有
溶液的烧杯中,参与反应的离子有
您最近一年使用:0次
2023-12-25更新
|
34次组卷
|
2卷引用:北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷
9 . 钠及其化合物在认识物质转化规律以及生产生活中均有重要应用。
Ⅰ.钠与水的反应
(1)将钠投入足量含有酚酞的水中,作了如下记录,将实验现象与匹配的实验结论连线:_______ 。
(2)写出钠与水反应的化学方程式_______ 。
(3)若反应中生成H2的体积为1.12L(标准状况下),则参与反应的金属Na的质量是_______ 。
(4)同物质类别的金属Mg也能与水发生反应,试着调用反应规律分析Na和Mg分别与水反应的剧烈程度:Na_______ Mg(填“>”“<”或“=”)。
Ⅱ.钠与氧气的反应
(5)钠与氧气反应的产物有多种可能,造成产物多样的原因是_______ 。
(6)其中产物_______ (填化学式)可用作潜水艇和呼吸面具中的供氧剂,写出其与CO2反应的化学方程式_______ 。
Ⅲ.碳酸钠、碳酸氢钠在食品加工方面有着广泛的用途
(7)下列关于Na2CO3的认识正确的是_______ 。
a.受热易分解 b.俗称纯碱、苏打 c.属于碱 d.可与酸反应
(8)传统蒸馒头常采用酵头发面,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸,需要额外添加“碱面”将酸去除。等质量的Na2CO3和NaHCO3,因_______ (填“Na2CO3”或“NaHCO3”)消耗酸更多,更适合作为中和发酵带来的酸味的“碱面”。
(9)若面团发得不好,面团内的气孔少,不够膨松。需添加_______ (填“Na2CO3”或“NaHCO3”),继续揉面,上锅蒸后也能蒸出松软的馒头。用化学方程式表示其产气原理_______ 。
Ⅰ.钠与水的反应
(1)将钠投入足量含有酚酞的水中,作了如下记录,将实验现象与匹配的实验结论连线:
实验现象 实验结论 A.钠浮在水面上 a.有碱生成B.钠四处游动 b.有气体产生 C.溶液变红 c.反应放热,钠熔点低 D.钠熔成光亮的小球 d.钠的密度比水小 |
(3)若反应中生成H2的体积为1.12L(标准状况下),则参与反应的金属Na的质量是
(4)同物质类别的金属Mg也能与水发生反应,试着调用反应规律分析Na和Mg分别与水反应的剧烈程度:Na
Ⅱ.钠与氧气的反应
(5)钠与氧气反应的产物有多种可能,造成产物多样的原因是
(6)其中产物
Ⅲ.碳酸钠、碳酸氢钠在食品加工方面有着广泛的用途
(7)下列关于Na2CO3的认识正确的是
a.受热易分解 b.俗称纯碱、苏打 c.属于碱 d.可与酸反应
(8)传统蒸馒头常采用酵头发面,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸,需要额外添加“碱面”将酸去除。等质量的Na2CO3和NaHCO3,因
(9)若面团发得不好,面团内的气孔少,不够膨松。需添加
您最近一年使用:0次
解题方法
10 . 选择完成下列实验的装置。
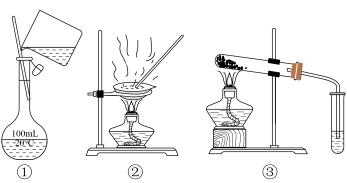
(1)从NaCl溶液中获取NaCl固体,用______ (填序号,下同)。
(2)比较Na2CO3和NaHCO3的热稳定性,用______ 。
(3)配制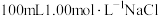 溶液,用
溶液,用______ 。

(1)从NaCl溶液中获取NaCl固体,用
(2)比较Na2CO3和NaHCO3的热稳定性,用
(3)配制
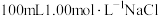 溶液,用
溶液,用
您最近一年使用:0次



