解题方法
1 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图为钠及其化合物的“价-类”二维图,请回答下列问题:
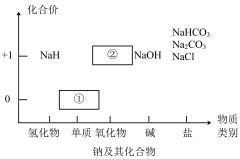
(1)物质①与水反应的离子方程式为_______ ,通常把物质①保存在_______ 中。
(2)写出淡黄色固体②与二氧化碳反应的化学方程式,并用双线桥法标识电子转移的方向和数目:_______ 。
(3)向50 mL沸水中加入5~6滴 饱和溶液,加热至产生红褐色液体,停止加热,该反应的化学方程式是:
饱和溶液,加热至产生红褐色液体,停止加热,该反应的化学方程式是:_______ 。利用_______ 来证明得到的分散系是氢氧化铁胶体。
(4)纯碱和小苏打都是重要的化工原料,在生产和生活中有若广泛的应用。
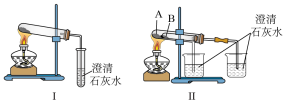
图Ⅱ中受热处发生反应的化学方程式为_______ 。
(5)下列关于 和
和 的说法不正确的是
的说法不正确的是_______ 。
A.相同条件下的溶解度;
B.可以用澄清石灰水区别 溶液和
溶液和 溶液
溶液
C.可以用加热的方法除去 固体中的
固体中的 杂质
杂质
D. 溶液和
溶液和 溶液均显碱性
溶液均显碱性
E.等质量的碳酸钠和碳酸氢钠与足量盐酸反应, 放出的气体多
放出的气体多

(1)物质①与水反应的离子方程式为
(2)写出淡黄色固体②与二氧化碳反应的化学方程式,并用双线桥法标识电子转移的方向和数目:
(3)向50 mL沸水中加入5~6滴
 饱和溶液,加热至产生红褐色液体,停止加热,该反应的化学方程式是:
饱和溶液,加热至产生红褐色液体,停止加热,该反应的化学方程式是:(4)纯碱和小苏打都是重要的化工原料,在生产和生活中有若广泛的应用。

图Ⅱ中受热处发生反应的化学方程式为
(5)下列关于
 和
和 的说法不正确的是
的说法不正确的是A.相同条件下的溶解度;

B.可以用澄清石灰水区别
 溶液和
溶液和 溶液
溶液C.可以用加热的方法除去
 固体中的
固体中的 杂质
杂质D.
 溶液和
溶液和 溶液均显碱性
溶液均显碱性E.等质量的碳酸钠和碳酸氢钠与足量盐酸反应,
 放出的气体多
放出的气体多
您最近一年使用:0次
名校
2 . 二氧化碳的循环对生活、生产和环境有着重要的影响。
Ⅰ、传统蒸馒头常采用酵头发面,酵头可使面团在微生物作用下产生 ,从而使面团疏松,同时生成乳酸和醋酸等酸性物质,再加入
,从而使面团疏松,同时生成乳酸和醋酸等酸性物质,再加入 可调节面团酸度。
可调节面团酸度。
(1)等质量的碳酸钠和碳酸氢钠,消耗酸更多的是______ 。
(2)若面团发得不好,面团内的气孔少,会略有酸味。厨师会选择向面团中添加 ,而不再用
,而不再用 ,继续揉面后,上锅蒸也能蒸出松软的馒头。请解释添加
,继续揉面后,上锅蒸也能蒸出松软的馒头。请解释添加 的两个作用
的两个作用______ 。
(3)已知磷的含氧酸盐难分解,复合膨松剂发酵的效果更明显。某品牌复合膨松剂的说明书如图所示。其中葡萄糖酸-δ-内酯和淀粉是助剂(防止膨松剂分解、吸潮结块而失效)。推测焦磷酸二氢二钠的作用是______ 。
Ⅱ、二氧化碳的捕捉与封存是未来实现低碳经济转型的重要途径。
(4)科学家设计出烧碱溶液捕捉 法,原理如图所示
法,原理如图所示
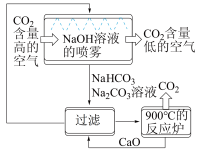
①该过程中能实现NaOH溶液再生的反应为 和
和______ 。
②若喷洒完100mL5mol/L的NaOH溶液后,测得吸收液中的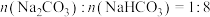 ,则被吸收的
,则被吸收的 在标况下的体积为
在标况下的体积为______ L。
③下列溶液中,也能用作“捕捉”二氧化碳试剂的是______ (填序号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀硫酸
溶液 D.稀硫酸
(5)Au@ 蛋黄型空心球催化剂技术实现了
蛋黄型空心球催化剂技术实现了 封存和能量储存双重效果,其原理如图1所示。制得的甲烷(
封存和能量储存双重效果,其原理如图1所示。制得的甲烷( )通过两步法可制取
)通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
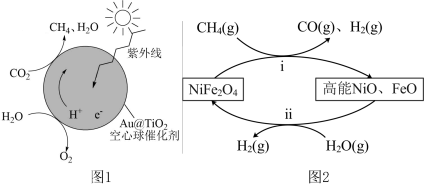
①已知 中H为+1价,则空心球催化剂技术中获得的
中H为+1价,则空心球催化剂技术中获得的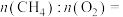
______ 。
②若不考虑过程中原料损失,则16g 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为______ mol。
Ⅰ、传统蒸馒头常采用酵头发面,酵头可使面团在微生物作用下产生
 ,从而使面团疏松,同时生成乳酸和醋酸等酸性物质,再加入
,从而使面团疏松,同时生成乳酸和醋酸等酸性物质,再加入 可调节面团酸度。
可调节面团酸度。(1)等质量的碳酸钠和碳酸氢钠,消耗酸更多的是
(2)若面团发得不好,面团内的气孔少,会略有酸味。厨师会选择向面团中添加
 ,而不再用
,而不再用 ,继续揉面后,上锅蒸也能蒸出松软的馒头。请解释添加
,继续揉面后,上锅蒸也能蒸出松软的馒头。请解释添加 的两个作用
的两个作用(3)已知磷的含氧酸盐难分解,复合膨松剂发酵的效果更明显。某品牌复合膨松剂的说明书如图所示。其中葡萄糖酸-δ-内酯和淀粉是助剂(防止膨松剂分解、吸潮结块而失效)。推测焦磷酸二氢二钠的作用是
| 【名称】xx复合膨松剂 【保质期】24个月 【净含量】1kg 【使用量】面粉用量的0.5%~2.5% 【配料】碳酸氢钠、焦磷酸二氢二钠、碳酸钙、葡萄糖酸-δ-内酯、淀粉 【适用范围】适用于各类馒头、包子等发酵面制品以及面包、糕点等的制作 【保存方法】阴凉干燥处存储 |
Ⅱ、二氧化碳的捕捉与封存是未来实现低碳经济转型的重要途径。
(4)科学家设计出烧碱溶液捕捉
 法,原理如图所示
法,原理如图所示
①该过程中能实现NaOH溶液再生的反应为
 和
和②若喷洒完100mL5mol/L的NaOH溶液后,测得吸收液中的
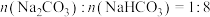 ,则被吸收的
,则被吸收的 在标况下的体积为
在标况下的体积为③下列溶液中,也能用作“捕捉”二氧化碳试剂的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀硫酸
溶液 D.稀硫酸(5)Au@
 蛋黄型空心球催化剂技术实现了
蛋黄型空心球催化剂技术实现了 封存和能量储存双重效果,其原理如图1所示。制得的甲烷(
封存和能量储存双重效果,其原理如图1所示。制得的甲烷( )通过两步法可制取
)通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
①已知
 中H为+1价,则空心球催化剂技术中获得的
中H为+1价,则空心球催化剂技术中获得的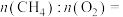
②若不考虑过程中原料损失,则16g
 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
3 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。
Ⅰ.下图为钠及其化合物的“价-类”二维图,请回答下列问题:
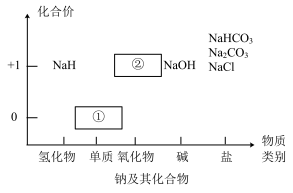
(1)物质①与水反应的离子方程式为___________ ,通常把物质①保存在___________ 中。
(2)写出淡黄色固体②与二氧化碳反应的化学方程式:___________ 。
(3)下列关于 和
和 的说法不正确的是___________。
的说法不正确的是___________。
Ⅱ.下图为铁及其化合物的“价-类”二维图,箭头表示部分物质间的转化关系。
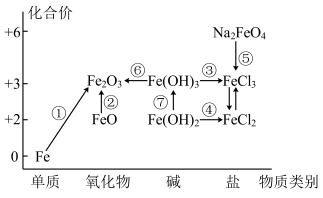
请回答以下问题:
(4)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:___________ 。
(5)已知 在强碱溶液中稳定存在,pH越小稳定性越差,则制备
在强碱溶液中稳定存在,pH越小稳定性越差,则制备 需在
需在___________ (填“酸性”“碱性”或“中性”)环境中进行; 也可以作为净水剂,能与水反应生成具有吸附性的
也可以作为净水剂,能与水反应生成具有吸附性的 胶体,且有氧气放出,写出其中离子方程式:
胶体,且有氧气放出,写出其中离子方程式:___________ 。其中检验溶液中 的试剂是
的试剂是___________ 。
Ⅰ.下图为钠及其化合物的“价-类”二维图,请回答下列问题:

(1)物质①与水反应的离子方程式为
(2)写出淡黄色固体②与二氧化碳反应的化学方程式:
(3)下列关于
 和
和 的说法不正确的是___________。
的说法不正确的是___________。A.相同条件下的溶解度: |
B.可以用澄清石灰水区别 溶液和 溶液和 溶液 溶液 |
C.可以用加热的方法除去 固体中的 固体中的 杂质 杂质 |
D.相同物质的量浓度下, 溶液的碱性比 溶液的碱性比 溶液的强 溶液的强 |
Ⅱ.下图为铁及其化合物的“价-类”二维图,箭头表示部分物质间的转化关系。

请回答以下问题:
(4)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(5)已知
 在强碱溶液中稳定存在,pH越小稳定性越差,则制备
在强碱溶液中稳定存在,pH越小稳定性越差,则制备 需在
需在 也可以作为净水剂,能与水反应生成具有吸附性的
也可以作为净水剂,能与水反应生成具有吸附性的 胶体,且有氧气放出,写出其中离子方程式:
胶体,且有氧气放出,写出其中离子方程式: 的试剂是
的试剂是
您最近一年使用:0次
名校
解题方法
4 . 元素的价一类二维图是我们学习元素及其化合物相关知识的重要模型和工具,图为钠的价一类二维图。请回答以下问题:

(1)NaH中H元素的化合价是___________ 。
(2)钠单质通常保存在___________ 中。
(3)请写出①中某种淡黄色固体的用途:___________ 。
(4)把钠放到装有水的烧杯中,钠会浮在水面上,原因是___________ ;金属钠与水反应的离子方程式是___________ 。
(5)利用如图实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为___________ ,写出实验过程中试管内发生反应的化学方程式:___________ 。


(1)NaH中H元素的化合价是
(2)钠单质通常保存在
(3)请写出①中某种淡黄色固体的用途:
(4)把钠放到装有水的烧杯中,钠会浮在水面上,原因是
(5)利用如图实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为

您最近一年使用:0次
名校
解题方法
5 . Na2CO3和NaHCO3是重要的化工原料,请回答:
(1)两物质的水溶液分别与足量盐酸混合,反应的离子方程式分别为___________ 、___________ 。
(2)除去NaHCO3溶液中少量Na2CO3的方法,写出化学方程式:___________ 。
(3)Na2CO3和NaHCO3的焰色试验分别为___________ 色、___________ 色。
(4)检验某盐中含有钾元素的方法是___________ ,具体操作为___________ 。
(1)两物质的水溶液分别与足量盐酸混合,反应的离子方程式分别为
(2)除去NaHCO3溶液中少量Na2CO3的方法,写出化学方程式:
(3)Na2CO3和NaHCO3的焰色试验分别为
(4)检验某盐中含有钾元素的方法是
您最近一年使用:0次
2023-08-16更新
|
270次组卷
|
2卷引用:广东省湛江市第二十一中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
6 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图为钠及其化合物的“价-类”二维图,请回答下列问题:

(1)物质①与水反应的离子方程式为_______ ,通常把物质①保存在_______ 中。
(2)写出淡黄色固体②与二氧化碳反应的化学方程式:_______ 。
(3)纯碱和小苏打都是重要的化工原料,在生产和生活中有若广泛的应用。

图I、II中_______ 能更好说明二者的稳定性。II中受热处发生反应的化学方程式为_______ 。
(4)下列关于 和
和 的说法不正确的是
的说法不正确的是_______ 。
A.相同条件下的溶解度;
B.可以用澄清石灰水区别 溶液和
溶液和 溶液
溶液
C.可以用加热的方法除去 固体中的
固体中的 杂质
杂质
D.等质量的碳酸钠和碳酸氢钠与足量盐酸反应, 放出的气体多
放出的气体多
E. 溶液和
溶液和 溶液均显碱性
溶液均显碱性

(1)物质①与水反应的离子方程式为
(2)写出淡黄色固体②与二氧化碳反应的化学方程式:
(3)纯碱和小苏打都是重要的化工原料,在生产和生活中有若广泛的应用。

图I、II中
(4)下列关于
 和
和 的说法不正确的是
的说法不正确的是A.相同条件下的溶解度;

B.可以用澄清石灰水区别
 溶液和
溶液和 溶液
溶液C.可以用加热的方法除去
 固体中的
固体中的 杂质
杂质D.等质量的碳酸钠和碳酸氢钠与足量盐酸反应,
 放出的气体多
放出的气体多E.
 溶液和
溶液和 溶液均显碱性
溶液均显碱性
您最近一年使用:0次
2022-12-10更新
|
488次组卷
|
2卷引用:广东省惠州市博罗县2022-2023学年高一上学期期中考试化学试题
7 . 有下列10种物质:①液态HCl,②NH4Cl,③蔗糖,④Cl2,⑤NaOH溶液,⑥熔融碳酸钠,⑦碳酸氢钠固体,⑧淀粉,⑨CaO,⑩H2O。回答下列问题:
(1)上述物质中,属于电解质的是_______ (填序号,下同),属于非电解质的是_______ ,在上述状态下能够导电的是_______ 。
(2)写出⑤和⑦反应的离子方程式:_______ 。
(3)在酒精灯火焰上灼烧,火焰呈黄色的,为_______ 。
(4)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的NaHCO3能治疗胃酸过多,请写出其反应的离子方程式:_______ 。
(5)除去Na2CO3粉末中混有的少量NaHCO3的方法是_______ ,化学方程式为_______ 。
(1)上述物质中,属于电解质的是
(2)写出⑤和⑦反应的离子方程式:
(3)在酒精灯火焰上灼烧,火焰呈黄色的,为
(4)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的NaHCO3能治疗胃酸过多,请写出其反应的离子方程式:
(5)除去Na2CO3粉末中混有的少量NaHCO3的方法是
您最近一年使用:0次
名校
解题方法
8 . 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,具体情况如图所示。

(1)写出碳酸氢钠的电离方程式_______ ,根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是_______ (填序号)
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,写出其中属于离子反应的离子方程式_______ 。
(3)若用实验Ⅳ确定碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是_______ (填化学式)
(4)将碳酸氢钠溶液与过量澄清石灰水反应时的离子方程式为_______ 。
(5)下列关于 和
和 的说法中,不正确的是
的说法中,不正确的是_______ 。
A.相同条件下的溶解度:
B.二者的溶液可用加入澄清石灰水的方法区别
C.可以用通入足量 的方法除去
的方法除去 溶液中的
溶液中的 杂质
杂质
D.mg碳酸钠和mg碳酸氢钠固体中分别加入几滴水后,测得温度较高的是
E.在图Ⅱ所示实验中两装置的气球都会膨胀,若忽略溶液温度变化,则②装置中的气球膨胀的更快
F.在图Ⅱ所示实验中若忽略溶液体积变化,则最终两试管中 的物质的量浓度相等
的物质的量浓度相等
(6)下列实验方案中,能测定出 和
和 混合物中物质的质量分数的是
混合物中物质的质量分数的是_______ ,选择其中一种可行的方法计算出 的质量分数
的质量分数_______ 。
A.取m克混合物充分加热,质量减少n克
B.取m克混合物与足量 溶液充分反应,得到n克溶液
溶液充分反应,得到n克溶液
C.取m克混合物与足量稀盐酸反应,加热、蒸干、灼烧,得到n克固体
D.取m克混合物与足量稀硫酸反应,逸出气体用碱石灰吸收,质量增加n克

(1)写出碳酸氢钠的电离方程式
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,写出其中属于离子反应的离子方程式
(3)若用实验Ⅳ确定碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是
(4)将碳酸氢钠溶液与过量澄清石灰水反应时的离子方程式为
(5)下列关于
 和
和 的说法中,不正确的是
的说法中,不正确的是A.相同条件下的溶解度:

B.二者的溶液可用加入澄清石灰水的方法区别
C.可以用通入足量
 的方法除去
的方法除去 溶液中的
溶液中的 杂质
杂质D.mg碳酸钠和mg碳酸氢钠固体中分别加入几滴水后,测得温度较高的是

E.在图Ⅱ所示实验中两装置的气球都会膨胀,若忽略溶液温度变化,则②装置中的气球膨胀的更快
F.在图Ⅱ所示实验中若忽略溶液体积变化,则最终两试管中
 的物质的量浓度相等
的物质的量浓度相等(6)下列实验方案中,能测定出
 和
和 混合物中物质的质量分数的是
混合物中物质的质量分数的是 的质量分数
的质量分数A.取m克混合物充分加热,质量减少n克
B.取m克混合物与足量
 溶液充分反应,得到n克溶液
溶液充分反应,得到n克溶液C.取m克混合物与足量稀盐酸反应,加热、蒸干、灼烧,得到n克固体
D.取m克混合物与足量稀硫酸反应,逸出气体用碱石灰吸收,质量增加n克
您最近一年使用:0次
解题方法
9 . 胃酸过多是常见的胃病之一,下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末,可缓慢分解,焰色反应为黄色;(2)能溶于水水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸发生中和作用缓慢而持久,可维持3到4小时。(2)凝胶本身覆盖于溃疡面上具有保护作用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测甲中含有的主要化学成分是___ ;乙中含有的主要化学成分是___ 。(填化学式)
(2)试写出甲中主要成分引起胃胀气的反应的离子方程式:___ 。
(3)试写出乙中的主要成分与氢氧化钠溶液反应的离子方程式:___ 。
甲:(1)白色结晶状粉末,可缓慢分解,焰色反应为黄色;(2)能溶于水水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸发生中和作用缓慢而持久,可维持3到4小时。(2)凝胶本身覆盖于溃疡面上具有保护作用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测甲中含有的主要化学成分是
(2)试写出甲中主要成分引起胃胀气的反应的离子方程式:
(3)试写出乙中的主要成分与氢氧化钠溶液反应的离子方程式:
您最近一年使用:0次



