名校
1 . 镍电池的电极活性材料为多组分合金(主要成分为镍、钴,还含有铝、铁等),可重新回收利用。利用废镍电池资源化生产醋酸钴晶体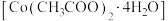 的工艺流程如下。
的工艺流程如下。
②部分金属阳离子沉淀的pH如下表。
请回答下列问题:
(1)“浸取”时可以提高浸取率的操作有___________ (任写1条)。
(2)“调pH”时溶液的pH范围是___________ ,所得滤渣1的主要成分为___________ (填化学式)。
(3)“氧化分离”操作控制溶液pH=2,加入NaClO发生反应的离子方程式为___________ 。
(4)“溶解1”操作中加入H2O2的作用为___________ ,“沉钴”操作过程中发生反应的离子方程式为___________ 。
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为___________ 。
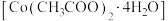 的工艺流程如下。
的工艺流程如下。
②部分金属阳离子沉淀的pH如下表。
| 沉淀物 |  |  | 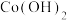 | Co(OH)3 |  |  |
| 开始沉淀pH | 2.2 | 7.4 | 7.6 | 0.1 | 4.0 | 7.6 |
| 完全沉淀pH | 3.2 | 8.9 | 9.2 | 1.1 | 5.2 | 9.2 |
(1)“浸取”时可以提高浸取率的操作有
(2)“调pH”时溶液的pH范围是
(3)“氧化分离”操作控制溶液pH=2,加入NaClO发生反应的离子方程式为
(4)“溶解1”操作中加入H2O2的作用为
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为
您最近一年使用:0次
真题
名校
2 . 用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是_______________ 1;
(2)KMnO4-氧化Fe2+的离子方程式补充完整:______
 1MnO
1MnO +
+ Fe2++
Fe2++ ______=
______= Mn2++
Mn2++ Fe3++
Fe3++ ______
______
(3)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的:._________________ ;
(4)已知:一定条件下,MnO 可与Mn2+反应生成MnO2,
可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是_____________ ;
②Ⅳ中加入MnSO4的目的是:______________ ;
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4-氧化Fe2+的离子方程式补充完整:
 1MnO
1MnO +
+ Fe2++
Fe2++ ______=
______= Mn2++
Mn2++ Fe3++
Fe3++ ______
______(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:.
(4)已知:一定条件下,MnO
 可与Mn2+反应生成MnO2,
可与Mn2+反应生成MnO2,①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是
②Ⅳ中加入MnSO4的目的是:
您最近一年使用:0次
2019-01-30更新
|
1889次组卷
|
4卷引用:2014届高考化学二轮复习四川配套训练 第10讲金属元素化合物练习卷
(已下线)2014届高考化学二轮复习四川配套训练 第10讲金属元素化合物练习卷2013年全国普通高等学校招生统一考试理科综合能力测试化学(北京卷)吉林省长春外国语学校2020-2021学年高一下学期期初考试化学试题河南省范县第一中学2021-2022学年高一上学期第三次月考检测化学试题



