名校
解题方法
1 . 由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4•7H2O),然后制取透明氧化铁颜料的流程如图:
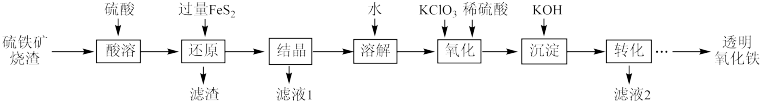
已知:
I.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
II.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)FeS2的电子式是_____ 。
(2)“滤渣”中的主要成分是_____ (填名称)。
(3)流程中“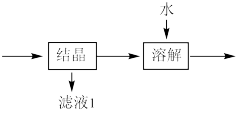 ”环节的目的是
”环节的目的是_____ 。
(4)“还原”过程中涉及的离子方程式为_____ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以_____ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。
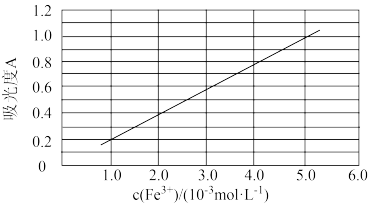
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁黄的质量分数为_____ 。

已知:
I.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
II.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)FeS2的电子式是
(2)“滤渣”中的主要成分是
(3)流程中“
 ”环节的目的是
”环节的目的是(4)“还原”过程中涉及的离子方程式为
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁黄的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 计算(要有计算过程)
(1)常温常压下,用等质量的 、
、 、
、 三种气体分别吹出三个气球,求三个气球的体积之比为
三种气体分别吹出三个气球,求三个气球的体积之比为______ 。
(2)把 溶液和
溶液和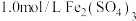 溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中
溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中 的物质的量浓度
的物质的量浓度___________ 。
(3)某种胃药的有效成分为碳酸钠,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①向一粒研碎后的药片(0.10g)中加入20.00ml蒸馏水;
②配置 稀盐酸和
稀盐酸和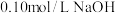 溶液;
溶液;
③加入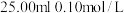 稀盐酸;
稀盐酸;
④用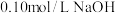 溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
某同学4次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数_________ 。
(1)常温常压下,用等质量的
 、
、 、
、 三种气体分别吹出三个气球,求三个气球的体积之比为
三种气体分别吹出三个气球,求三个气球的体积之比为(2)把
 溶液和
溶液和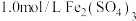 溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中
溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中 的物质的量浓度
的物质的量浓度(3)某种胃药的有效成分为碳酸钠,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①向一粒研碎后的药片(0.10g)中加入20.00ml蒸馏水;
②配置
 稀盐酸和
稀盐酸和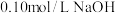 溶液;
溶液;③加入
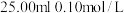 稀盐酸;
稀盐酸;④用
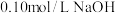 溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
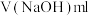 | 13.00 | 12.90 | 13.10 | 13.50 |
您最近一年使用:0次
3 . 黄铜矿 是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
 冶炼铜的反应为
冶炼铜的反应为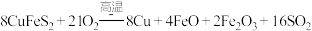 若
若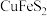 中Fe的化合价为
中Fe的化合价为 ,反应中被还原的元素是
,反应中被还原的元素是______  填元素符号
填元素符号 .
.
 冶炼铜的主要流程如图:
冶炼铜的主要流程如图:
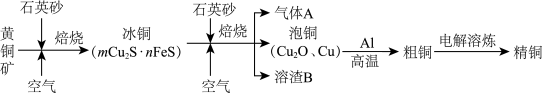
 气体A中的大气污染物可选用下列试剂中的
气体A中的大气污染物可选用下列试剂中的______ 吸收.
 浓
浓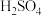
 稀
稀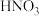
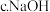 溶液
溶液
 用稀
用稀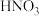 浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为
浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为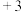 的结论.请指出该结论是否合理并说明理由
的结论.请指出该结论是否合理并说明理由______ .
 冶炼出的铜可以发生下列反应
冶炼出的铜可以发生下列反应 图
图
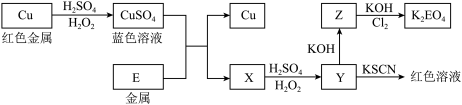
 写出Cu溶于稀
写出Cu溶于稀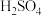 和
和 混合液的离子方程式:
混合液的离子方程式:______ .
 写出
写出 将Z氧化为
将Z氧化为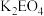 的化学方程式:
的化学方程式:______ .
 对于
对于
 溶液,正确的是
溶液,正确的是______ .
A、常温下,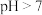
B、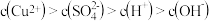
C、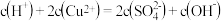
 是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物. 冶炼铜的反应为
冶炼铜的反应为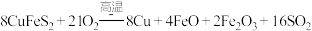 若
若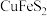 中Fe的化合价为
中Fe的化合价为 ,反应中被还原的元素是
,反应中被还原的元素是 填元素符号
填元素符号 .
. 冶炼铜的主要流程如图:
冶炼铜的主要流程如图:
 气体A中的大气污染物可选用下列试剂中的
气体A中的大气污染物可选用下列试剂中的 浓
浓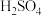
 稀
稀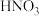
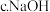 溶液
溶液 用稀
用稀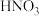 浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为
浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为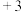 的结论.请指出该结论是否合理并说明理由
的结论.请指出该结论是否合理并说明理由 冶炼出的铜可以发生下列反应
冶炼出的铜可以发生下列反应 图
图

 写出Cu溶于稀
写出Cu溶于稀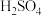 和
和 混合液的离子方程式:
混合液的离子方程式: 写出
写出 将Z氧化为
将Z氧化为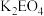 的化学方程式:
的化学方程式: 对于
对于
 溶液,正确的是
溶液,正确的是A、常温下,
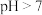
B、
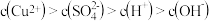
C、
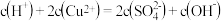
您最近一年使用:0次
2020-01-04更新
|
143次组卷
|
3卷引用:新疆和田地区于田县2022-2023学年高三上学期11月期中化学试题
名校
4 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是________ (填氧化剂、还原剂),与CO2反应的化学反应方程式_________________________ 。
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:___________________________________________________________ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为____ mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________ 。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c=_______ (用含a、b的代数式表示)。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c=
您最近一年使用:0次
2018-11-25更新
|
741次组卷
|
2卷引用:新疆维吾尔自治区喀什第六中学2022-2023学年高二上学期第一次月考化学试题
5 . 为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
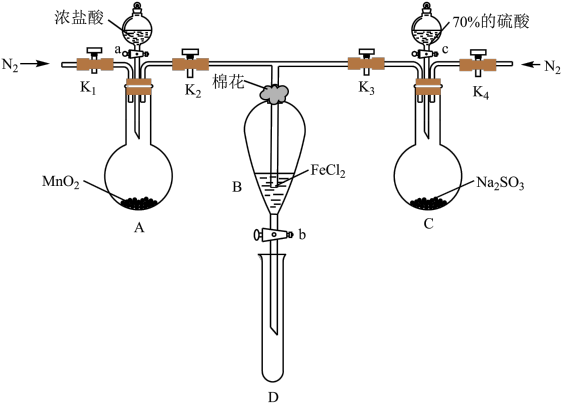
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________________________________________ 。
(2)棉花中浸润的溶液为________________ ,作用是_____________________________________________ 。
(3)A中发生反应的化学方程式________________________________________________ 。
(4)导致步骤Ⅲ中溶液变黄的离子反应是________________________________________ ,用________ (写试剂化学式)检验氧化产物,现象是____________________________________________ 。
(5)能说明氧化性Fe3+>SO2的离子方程式是_______________________________ 。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______ (填“甲”“乙”“丙”)。

Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是
(2)棉花中浸润的溶液为
(3)A中发生反应的化学方程式
(4)导致步骤Ⅲ中溶液变黄的离子反应是
(5)能说明氧化性Fe3+>SO2的离子方程式是
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是
| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
您最近一年使用:0次
2018-02-25更新
|
762次组卷
|
5卷引用:新疆维吾尔自治区喀什第六中学2022-2023学年高一上学期11月月考化学试题
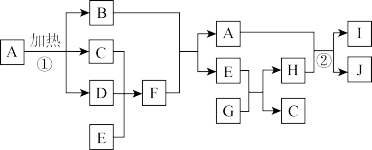
6 . 有关物质的转化关系如下图所示。B是红棕色固体,D是红棕色气体,E是常见的无色液体,G是淡黄色粉末。
(1) F的化学式为____________ 。
(2) G的电子式为____________ 。
(3) 写出反应①的化学方程式________________ 。
(4) 写出反应②的离子方程式________________ 。
(1) F的化学式为
(2) G的电子式为
(3) 写出反应①的化学方程式
(4) 写出反应②的离子方程式
您最近一年使用:0次
2017-03-13更新
|
394次组卷
|
2卷引用:新疆克孜勒苏柯尔克孜自治州第一中学2022-2023学年高三上学期11月期中化学试题
7 . 将8gFe2O3投入150mL的稀硫酸中,再投入7g铁粉,共收集到1.68L氢气(标准状况下),同时固体均无剩余,向溶液中滴入KSCN溶液,未见颜色变化。为了中和多余的硫酸,且使Fe2+全部转化为Fe(OH)2沉淀,共消耗4mol/L的NaOH溶液150mL,则原硫酸的物质的量浓度为mol/L。
| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2017-02-27更新
|
470次组卷
|
2卷引用:新疆和田地区于田县2022-2023学年高三上学期11月期中化学试题



