1 . 实验目的:为研究铁质材料与热浓硫酸的反应
(1)称取铁钉(碳素钢 )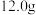 放入
放入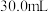 浓硫酸中,加热,充分反应后得到溶液
浓硫酸中,加热,充分反应后得到溶液 并收集到气体
并收集到气体 。
。
①甲同学认为 中除
中除 外还可能含有
外还可能含有 。若要确认其中是否含有
。若要确认其中是否含有 ,应选择加入的试剂为
,应选择加入的试剂为___________ (选填序号)
A. 溶液和氯水 B.铁粉和
溶液和氯水 B.铁粉和 溶液 C.浓氨水 D.酸性
溶液 C.浓氨水 D.酸性 溶液
溶液
②乙同学取 (标准状况)气体
(标准状况)气体 通入足量溴水中,然后加入足量
通入足量溴水中,然后加入足量 溶液,经适当操作后得到干燥固体
溶液,经适当操作后得到干燥固体 。据此推知气体
。据此推知气体 中
中 的体积分数为
的体积分数为___________ 。(保留三位有效数字)。
(2)分析上述实验中 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有 和
和 气体。为此设计了下列探究实验装置(图中夹持仪器省略)。气体Y中还有
气体。为此设计了下列探究实验装置(图中夹持仪器省略)。气体Y中还有 的原因是
的原因是___________ 。

(3)装置A中试剂的作用是___________ ,反应的离子方程式___________ 。
(4)简述确认气体Y中含有 的实验现象
的实验现象___________ 。
(5)如果气体Y中含有 ,预计实验现象应是
,预计实验现象应是___________ 。
(1)称取铁钉(
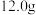 放入
放入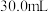 浓硫酸中,加热,充分反应后得到溶液
浓硫酸中,加热,充分反应后得到溶液 并收集到气体
并收集到气体 。
。①甲同学认为
 中除
中除 外还可能含有
外还可能含有 。若要确认其中是否含有
。若要确认其中是否含有 ,应选择加入的试剂为
,应选择加入的试剂为A.
 溶液和氯水 B.铁粉和
溶液和氯水 B.铁粉和 溶液 C.浓氨水 D.酸性
溶液 C.浓氨水 D.酸性 溶液
溶液②乙同学取
 (标准状况)气体
(标准状况)气体 通入足量溴水中,然后加入足量
通入足量溴水中,然后加入足量 溶液,经适当操作后得到干燥固体
溶液,经适当操作后得到干燥固体 。据此推知气体
。据此推知气体 中
中 的体积分数为
的体积分数为(2)分析上述实验中
 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有 和
和 气体。为此设计了下列探究实验装置(图中夹持仪器省略)。气体Y中还有
气体。为此设计了下列探究实验装置(图中夹持仪器省略)。气体Y中还有 的原因是
的原因是
(3)装置A中试剂的作用是
(4)简述确认气体Y中含有
 的实验现象
的实验现象(5)如果气体Y中含有
 ,预计实验现象应是
,预计实验现象应是
您最近一年使用:0次
2021-10-10更新
|
285次组卷
|
5卷引用:辽宁省沈阳市郊联体2022届高三10月月考化学试题
2 . 下列实验操作、现象及结论都正确的是
| 选项 | 实验目的 | 实验操作 | 现象和结论 |
| A | 探究甲烷气体中是否含有氢气 | 将气体样品通入灼热的氧化铜,然后再通过CuSO4粉末 | 氧化铜固体变为红色,CuSO4粉末变蓝色,说明含有氢气 |
| B | 探究Fe与水蒸气高温反应的固体产物中铁元素的化合价 | 取少量反应后固体于试管中,加足量的稀盐酸溶解,分成两份:一份中滴加硫氰化钾溶液,另一份中滴加酸性高锰酸钾溶液 | 若前者溶液变血红色,后者溶液紫色褪去,则固体产物中铁元素有+2、+3两种化合价 |
| C | 探究乙烯能否被酸性高锰酸钾氧化 | 向乙醇中加入适量浓硫酸制备乙烯,将产生的气体通入酸性高锰酸钾溶液中 | 溶液紫红色褪去,说明乙烯能被酸性高锰酸钾氧化 |
| D | 探究Fe3+、Cu2+对H2O2溶液分解的催化效果强弱 | 在a、b两支试管中各加2mL 5% H2O2溶液,分别滴入0.2mol/L FeCl3溶液和0.3mol/L CuCl2溶液各0.5mL | 若a中产生气泡快于b中,则说明Fe3+的催化效果强于Cu2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 下列设计的实验方案能达到实验目的的是
| A.制备银氨溶液:向2%的氨水中逐滴加入足量的2%的AgNO3溶液 |
| B.检验淀粉是否水解:在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水,观察现象 |
| C.检验溶液中是否有Fe3+:向该溶液中加入Na2O2粉末,产生红褐色沉淀和无色气体 |
| D.验证Fe3+与I-的反应有一定限度:向5 mL0.1 mol·L-1KI溶液中滴入0.1 mol·L-1 FeCl3溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象 |
您最近一年使用:0次
名校
4 . 用下列装置能达到实验目的的是
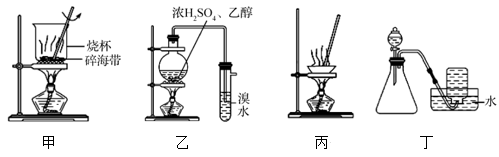

| A.用装置甲灼烧碎海带 |
| B.用装置乙制备乙烯并检验乙烯 |
| C.用装置丙蒸发FeCl3溶液得到FeCl3固体 |
| D.用装置丁使Cu和稀硝酸反应制取NO |
您最近一年使用:0次
2021-09-11更新
|
269次组卷
|
3卷引用:湖北省新高考联考协作体2021-2022学年高三上学期起点考试化学试题
5 . 下列实验操作或装置能达到实验目的的是
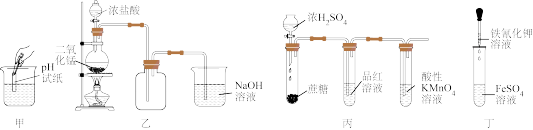

| A.用甲装置测定0.1mol·L-1KClO溶液的pH |
| B.用乙装置制备纯净干燥的Cl2 |
| C.用丙装置验证蔗糖与浓硫酸反应产生SO2 |
| D.用丁装置可检验FeSO4溶液中的Fe2+是否被氧化 |
您最近一年使用:0次
2021-04-14更新
|
309次组卷
|
2卷引用:黑龙江省大庆市2021届高三第一次教学质量检测理综化学试题
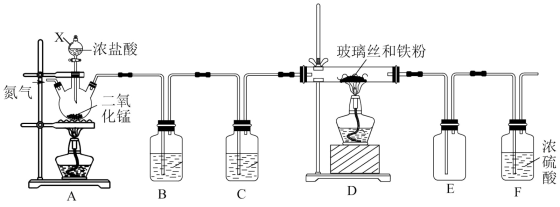
6 . 某化学学习小组在实验室制备无水三氯化铁,其实验装置如图。三氯化铁是棕黄色、易潮解、100℃能升华的物质。
回答下列问题:
(1)装置A中三颈烧瓶里反应的离子方程式是_______ 。
(2)为得到纯净、干燥的Cl2,B、C中的试剂分别为_______ 、_______ 。
(3)实验开始前先通氮气的目的是_______ 。
(4)为使氯气与铁充分反应,应注意的操作是_______ 。
(5)请你评价该装置的主要缺点是_______ 。
(6)设计实验证明D中反应产物中一定含有Fe3+:(要求有试剂、现象和操作)_______ 。

回答下列问题:
(1)装置A中三颈烧瓶里反应的离子方程式是
(2)为得到纯净、干燥的Cl2,B、C中的试剂分别为
(3)实验开始前先通氮气的目的是
(4)为使氯气与铁充分反应,应注意的操作是
(5)请你评价该装置的主要缺点是
(6)设计实验证明D中反应产物中一定含有Fe3+:(要求有试剂、现象和操作)
您最近一年使用:0次
2024-04-03更新
|
49次组卷
|
2卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期中测试化学试题
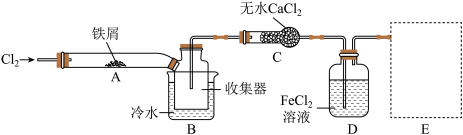
7 . FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
已知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端,要使沉积的FeCl3进入收集器,第④步操作是_______ 。
(2)操作步骤中,为防止FeCl3潮解所采取的措施有_______ (填步骤序号)。
(3)装置B中冷水浴的作用为_______ ;装置C的名称为_______ 。
(4)在虚线框中可以使用的装置有_______ 。
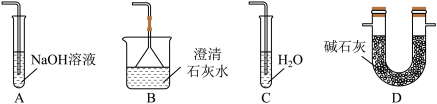
(5)反应结束后,A管中仍有部分固体,为探究该固体的成分,将其取出少量并加水溶解,分别进行了下列三组实验,如下表所示:
由此可推测A管中剩余固体的成分有_______
(6)该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,FeCl3与H2S反应的离子方程式为_______ 。该反应有两个显著优点:①H2S的原子利用率为100%;②_______ 。
已知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端,要使沉积的FeCl3进入收集器,第④步操作是
(2)操作步骤中,为防止FeCl3潮解所采取的措施有
(3)装置B中冷水浴的作用为
(4)在虚线框中可以使用的装置有

(5)反应结束后,A管中仍有部分固体,为探究该固体的成分,将其取出少量并加水溶解,分别进行了下列三组实验,如下表所示:
| 实验 | 操作 | 现象 |
| 甲 | 向试管中加入少量稀盐酸 | 有气泡放出 |
| 乙 | 向另一试管中加入少量KSCN | 无明显现象 |
| 丙 | 向乙同学试验后的试管中通入少量氯气 | 溶液变红色 |
(6)该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,FeCl3与H2S反应的离子方程式为
您最近一年使用:0次
8 . 下列关于 、
、 性质实验的说法错误的是
性质实验的说法错误的是
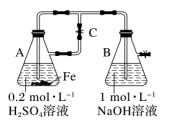
 、
、 性质实验的说法错误的是
性质实验的说法错误的是
A.用如图装置可以制备 |
B.向足量含有淀粉的 溶液中滴加 溶液中滴加 滴氯水,溶液变蓝,说明还原性: 滴氯水,溶液变蓝,说明还原性: |
C.向某溶液中滴加 溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有 溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有 |
D.向 溶液中加入少量铁粉是为了防止 溶液中加入少量铁粉是为了防止 被氧化 被氧化 |
您最近一年使用:0次
名校
解题方法
9 . 无水 易潮解,在医药、工业生产中有广泛应用。实验室可用氯化氢与铁粉在高温下反应制得。实验室用浓硫酸和氯化钠固体共热制备氯化氢。某小组设计实验制备无水
易潮解,在医药、工业生产中有广泛应用。实验室可用氯化氢与铁粉在高温下反应制得。实验室用浓硫酸和氯化钠固体共热制备氯化氢。某小组设计实验制备无水 并探究其性质。
并探究其性质。
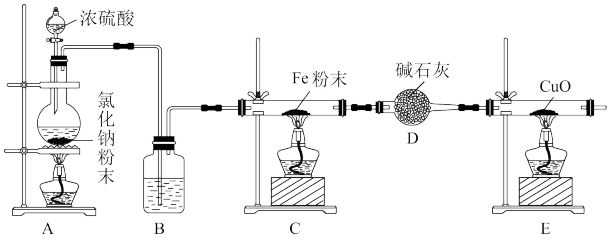
请回答下列问题:
(1)B装置中试剂是___________ (填名称),D装置作用是___________ 。
(2)如果A装置中生成酸式盐,化学方程式为___________ 。
(3)能证明C装置中已开始反应的现象是___________ 。
(4)从实验安全角度考虑,本实验有明显不足,改进方法是___________ 。
(5)实验完毕后,证明C装置残留固体是否含铁粉的实验方案是___________ (写出步骤、现象和结论。
(6)为了探究 具有还原性,设计如下方案:
具有还原性,设计如下方案:
取C装置中残留固体溶于水,将溶液分成甲、乙、丙三份,进行如下实验:
能证明 具有还原性的实验是
具有还原性的实验是___________ (填代号),丙实验中溶液由无色变红色的原因是___________ (用离子方程式表示)。
 易潮解,在医药、工业生产中有广泛应用。实验室可用氯化氢与铁粉在高温下反应制得。实验室用浓硫酸和氯化钠固体共热制备氯化氢。某小组设计实验制备无水
易潮解,在医药、工业生产中有广泛应用。实验室可用氯化氢与铁粉在高温下反应制得。实验室用浓硫酸和氯化钠固体共热制备氯化氢。某小组设计实验制备无水 并探究其性质。
并探究其性质。
请回答下列问题:
(1)B装置中试剂是
(2)如果A装置中生成酸式盐,化学方程式为
(3)能证明C装置中已开始反应的现象是
(4)从实验安全角度考虑,本实验有明显不足,改进方法是
(5)实验完毕后,证明C装置残留固体是否含铁粉的实验方案是
(6)为了探究
 具有还原性,设计如下方案:
具有还原性,设计如下方案:取C装置中残留固体溶于水,将溶液分成甲、乙、丙三份,进行如下实验:
| 实验 | 操作 | 现象 |
| 甲 | 加入镁粉 | 浅绿色逐渐变无色 |
| 乙 | 依次滴加 溶液、新制氯水 溶液、新制氯水 | 开始不变色,后变红色 |
| 丙 | 先滴加 溶液,后滴加酸化的双氧水 溶液,后滴加酸化的双氧水 | 开始不变色,后变红色 |
 具有还原性的实验是
具有还原性的实验是
您最近一年使用:0次
2022-01-03更新
|
318次组卷
|
2卷引用:江西省38个学校2021-2022学年高一上学期12月选科联考摸底考试化学试题
10 .  可用作净水剂、还原剂等。回答下列问题:
可用作净水剂、还原剂等。回答下列问题:
Ⅰ.制备 。装置如图所示(夹持装置省略)。已知
。装置如图所示(夹持装置省略)。已知 极易水解。
极易水解。
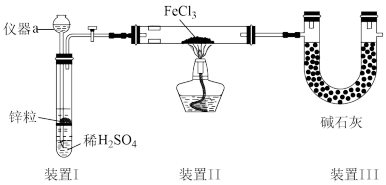
(1)仪器a的名称是___________ 。
(2)装置Ⅱ中制备 的化学方程式为
的化学方程式为___________ ,装置Ⅲ的作用:①吸收尾气;②___________ 。
(3)该装置存在的缺陷是___________ 。
Ⅱ.利用惰性电极电解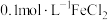 溶液,探究外界条件对电极反应产物的影响。
溶液,探究外界条件对电极反应产物的影响。
(4)实验数据如下表所示:
①实验2、3中阳极产生的气体是___________ (填化学式)。
②实验中,调节 溶液的
溶液的 宜选用
宜选用___________ (填“盐酸”、“硝酸”或“硫酸”)。
③由实验1、2现象可以得出结论___________ ;由实验1、4现象可以得出结论___________ 。
 可用作净水剂、还原剂等。回答下列问题:
可用作净水剂、还原剂等。回答下列问题:Ⅰ.制备
 。装置如图所示(夹持装置省略)。已知
。装置如图所示(夹持装置省略)。已知 极易水解。
极易水解。
(1)仪器a的名称是
(2)装置Ⅱ中制备
 的化学方程式为
的化学方程式为(3)该装置存在的缺陷是
Ⅱ.利用惰性电极电解
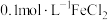 溶液,探究外界条件对电极反应产物的影响。
溶液,探究外界条件对电极反应产物的影响。(4)实验数据如下表所示:
| 实验编号 | 电压 |  | 阳极现象 | 阴极现象 |
| 1 | 1.5 | 5.52 | 无气泡,滴加 显红色 显红色 | 无气泡,银白色金属析出 |
| 2 | 3.0 | 5.52 | 少量气泡,滴加 显红色 显红色 | 无气泡,银白色金属析出 |
| 3 | 4.5 | 5.52 | 大量气泡,滴加 显红色 显红色 | 较多气泡,极少量金属析出 |
| 4 | 1.5 |  | 无气泡,滴加 显红色 显红色 | 较多气泡,极少量金属析出 |
②实验中,调节
 溶液的
溶液的 宜选用
宜选用③由实验1、2现象可以得出结论
您最近一年使用:0次



