1 . 乳酸亚铁晶体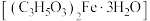 是一种吸收效果很好的食品铁强化剂,易溶于水,难溶于乙醇。某兴趣小组用废铁屑(部分被氧化)制备
是一种吸收效果很好的食品铁强化剂,易溶于水,难溶于乙醇。某兴趣小组用废铁屑(部分被氧化)制备 ,再与乳酸反应制得乳酸亚铁晶体。
,再与乳酸反应制得乳酸亚铁晶体。
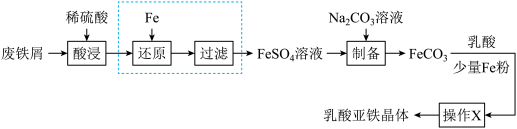
(1)“酸浸”时, 单质发生反应的离子方程式有
单质发生反应的离子方程式有___________ 。
(2)向酸浸液中滴加___________ (填化学式)溶液可判断是否要进行“还原”、“过滤”操作;在实验室中进行过滤操作需要的玻璃仪器有___________ 。
(3)制备过程中将 溶液加入
溶液加入 溶液中制得
溶液中制得 。
。
①该反应的离子方程式为___________ 。
②若 置于空气中时间过长,表面生成
置于空气中时间过长,表面生成 ,其原因是
,其原因是___________ (用化学方程式表示)。
(4) 与乳酸反应过程中加入少量铁粉的目的是
与乳酸反应过程中加入少量铁粉的目的是___________ 。
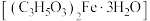 是一种吸收效果很好的食品铁强化剂,易溶于水,难溶于乙醇。某兴趣小组用废铁屑(部分被氧化)制备
是一种吸收效果很好的食品铁强化剂,易溶于水,难溶于乙醇。某兴趣小组用废铁屑(部分被氧化)制备 ,再与乳酸反应制得乳酸亚铁晶体。
,再与乳酸反应制得乳酸亚铁晶体。
(1)“酸浸”时,
 单质发生反应的离子方程式有
单质发生反应的离子方程式有(2)向酸浸液中滴加
(3)制备过程中将
 溶液加入
溶液加入 溶液中制得
溶液中制得 。
。①该反应的离子方程式为
②若
 置于空气中时间过长,表面生成
置于空气中时间过长,表面生成 ,其原因是
,其原因是(4)
 与乳酸反应过程中加入少量铁粉的目的是
与乳酸反应过程中加入少量铁粉的目的是
您最近一年使用:0次
名校
解题方法
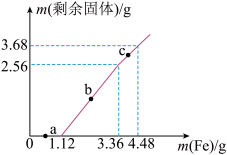
2 . 向
 和
和 的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量关系如图所示。下列说法正确的是
的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量关系如图所示。下列说法正确的是

 和
和 的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量关系如图所示。下列说法正确的是
的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量关系如图所示。下列说法正确的是
A.c点时溶液中的离子反应是: |
B.a点时溶液中金属阳离子只有 和 和 |
C.原溶液中 物质的量浓度为 物质的量浓度为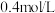 |
D.原溶液中 的物质的量为 的物质的量为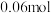 |
您最近一年使用:0次
2023-02-02更新
|
493次组卷
|
2卷引用:江西省上饶市2022-2023学年高一上学期期末教学质量测试化学试题
名校
解题方法
3 . 在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量之比为3:2:1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变为1:2:4,则参加反应的铁粉和原溶液中Fe3+的物质的量之比为
| A.2:1 | B.1:2 | C.1:3 | D.1:4 |
您最近一年使用:0次
2021-09-09更新
|
1678次组卷
|
28卷引用:2014-2015江西省新余市高一上学期期末考试化学试卷
2014-2015江西省新余市高一上学期期末考试化学试卷江西省鹰潭市第一中学2021届高三上学期期中考试化学试题(已下线)2010年甘肃省武威五中高二11月月考化学试卷2015届河北省邯郸市高三上学期1月教学质量检测化学试卷2014-2015学年辽宁师大附中高二下学期期末考试化学试卷2015-2016学年陕西省长安区一中高一上期末化学试卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【押题专练】【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一上学期12月月考化学试题安徽省阜阳市第三中学2018-2019学年高一上学期小期末考试(期末模拟)化学试题河北省大名县第一中学2020届高三9月月考化学试题河北省武安市第一中学2020届高三9月月考化学试题甘肃省兰州市第一中学2020届高三9月月考化学试题宁夏石嘴山市第三中学2019-2020学年高一上学期第二次(12月)月考化学试题安徽省安庆一中2018-2019学年高一上学期期末考试化学试题安徽省太和第一中学2019-2020学年高一上学期期末考试化学试题人教版高中化学必修1第三章《金属及其化合物》测试卷2专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)3.1.2 铁的氢氧化物 铁盐和亚铁盐练习(1)——《高中新教材同步备课》(人教版 必修第一册)(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)人教版(2019)高一必修第一册第三章 铁 金属材料 素养拓展区人教版(2019)高一必修第一册 第三章素养检测重庆市三峡名校联盟2020-2021学年高一上学期12月联考化学试题四川省仁寿第一中学校南校区2020-2021学年高一下学期开学考试化学试题(已下线)8.1 铁及其化合物-2020-2021学年秋季班高二上学期化学教材知识点精讲练(沪科版)(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)黑龙江省七台河市勃利县高级中学2021-2022学年高三上学期期中考试化学试题广东省普宁市华侨中学2021—2022学年高一上学期第三次月考化学试题陕西省延安子长市中学2021-2022学年高三上学期期中考试化学试题
名校
4 . 向含有xmolHNO3和ymolH2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是
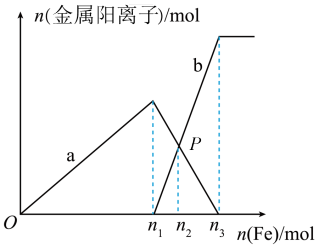
A.当x=y时,反应后溶液中一定有 |
| B.加入n3mol铁粉后b线保持不变说明n1mol铁粉后溶液中一定无H+ |
| C.由图可知,y≤1.5x |
| D.当x=1,y=1时最多溶解铁粉质量为56.0g |
您最近一年使用:0次
2021-03-14更新
|
688次组卷
|
6卷引用:江西省南昌县莲塘第一中学2020-2021学年高一3月质量检测化学试题
名校
解题方法
5 . 常温时,将0.1 mol Fe(NO3)3和2 mol HCl溶于水得2 L混合溶液,然后向该溶液投入m g铁粉使其充分反应后,滴加KSCN溶液不变红色。下列有关说法正确的是( )
| A.由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+ |
| B.当加入16.8 g铁粉时,可生成标准状况下6.72 L气体 |
| C.在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 |
| D.m≥28,反应过程中溶液的质量一直在减小 |
您最近一年使用:0次
2020-08-15更新
|
413次组卷
|
8卷引用:江西省丰城中学2023-2024学年高一上学期12月月考化学试题
江西省丰城中学2023-2024学年高一上学期12月月考化学试题2015届山东省青岛市高三下学期第二次模拟考试理综化学试卷(已下线)2019年8月5日《每日一题》2020年高考一轮复习—— Fe2+、Fe3+的检验(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精练)——2021年高考化学一轮复习讲练测(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)
6 . 某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下,请回答下列问题:

(1)步骤①的作用是清洗废铁屑表面的油污,其中加热的目的是____________ 。
(2)写出步骤②中生成 的离子方程式
的离子方程式______________________ 。(写一个即可)
(3)步骤③中“氯气”不引入杂质但有毒,可以用___________ 代替(填化学式)。
(4)若溶液B中只含有 而不含
而不含 ,可证明该事实的实验操作是
,可证明该事实的实验操作是__________ 。
(5)步骤⑤产生金属铜的化学方程式为______________________________ 。

(1)步骤①的作用是清洗废铁屑表面的油污,其中加热的目的是
(2)写出步骤②中生成
 的离子方程式
的离子方程式(3)步骤③中“氯气”不引入杂质但有毒,可以用
(4)若溶液B中只含有
 而不含
而不含 ,可证明该事实的实验操作是
,可证明该事实的实验操作是(5)步骤⑤产生金属铜的化学方程式为
您最近一年使用:0次
名校
7 . 工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:
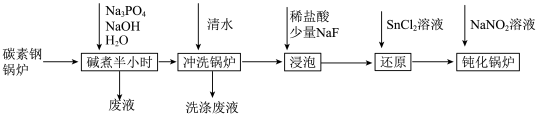
已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________ 。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________ ;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________ 。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________ ;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________ (填现象),则保护膜致密性欠佳。
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________ 。

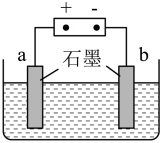
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________ 。

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
| 难溶物 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 | Ca3(PO4)2 |
| Ksp | 2.8×10-9 | 7.1×10-5 | 5.6×10-12 | 6.8×10-6 | 2.1×10-33 |
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为

(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为

您最近一年使用:0次
2019-03-06更新
|
1212次组卷
|
3卷引用:江西省赣州市信丰中学2020-2021学年高三上学期第五次月考化学试题
2018·江苏无锡·一模
8 . 现有硫酸铁、硫酸亚铁和硫酸混合溶液200 mL,现将其分成两等份,往其中一份中滴加足量BaCl2溶液,产生25.63g白色沉淀,往另一份中投入足量铁片,放出1.12 L气体(标准状况下)。下列判断不正确的是
| A.溶解的铁为0.05 mol﹤n(Fe) ﹤0.07 mol |
| B.原混合液中c(H+)=0.5 mol·L-1 |
| C.原混合液中c(Fe3+) 可能为0.1 mol·L-1 |
| D.溶液中离子有3n(Fe3+)+n(H+) +2n(Fe2+)=2n(SO42-) |
您最近一年使用:0次
2019-02-24更新
|
331次组卷
|
3卷引用:【南昌新东方】莲塘一中2020届高三12月质量检测
(已下线)【南昌新东方】莲塘一中2020届高三12月质量检测【市级联考】江苏省无锡市2018-2019学年高二上学期学业水平模拟化学试题江苏省徐州市2021-2022学年高二上学期学业水平合格性考试模拟试卷(12月)化学试题
名校
解题方法
9 . 将6 g的铁粉加入200 mLFe2(SO4)3和CuSO4的混合溶液,充分反应得到200 mL0.5mol /LFeSO4溶液和5.2 g固体沉淀物。试计算
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度。
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度。
您最近一年使用:0次
2016-12-09更新
|
879次组卷
|
9卷引用:江西省抚州市南城县第二中学2019-2020学年高一上学期第二次月考化学试题
江西省抚州市南城县第二中学2019-2020学年高一上学期第二次月考化学试题(已下线)2011-2012学年陕西省陕师大附中高一上学期期末试题化学(理)试卷2014-2015山西省山大附中高一12月月考化学试卷2015-2016学年河南省周口市高一上学期期末考试化学试卷【全国百强校】山西省山西大学附属中学2018-2019学年高一上学期12月月考化学试题(已下线)【南昌新东方】师大附中2019-2020 高一(上) 期末(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)黑龙江嫩江市高级中学2020-2021学年高一上学期第一次月考化学试题甘肃省武威市凉州区2021-2022学年高一上学期期末考试化学试题



