解题方法
1 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。
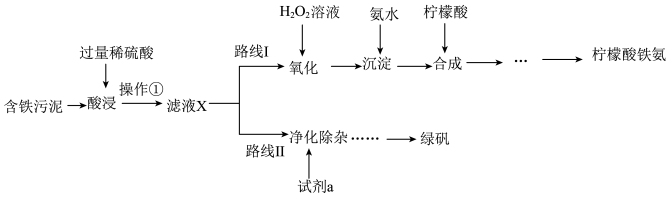
根据所学知识,回答下列问题:
(1)操作①的名称______ ,路线I中,加入H2O2溶液的目的是______ 。
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:______ ;检验含有Fe3+的方法是______ 。
(3)“滤液X”中一定含有的阳离子为_______ 。
(4)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是_____ ,请写出相应的离子方程式:______ 。

根据所学知识,回答下列问题:
(1)操作①的名称
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:
(3)“滤液X”中一定含有的阳离子为
(4)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
您最近半年使用:0次
2 . Ⅰ.钠、铝、铁是三种重要的金属,它们的单质及其化合物在生活生产中有重要的作用。请回答下列问题:
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:_______ ,该反应中氧化剂和还原剂的物质的量之比为______ 。
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是: 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
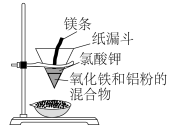
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ (填化学式),该试剂与金属铝反应的离子方程式为_______ 。
(3)另一同学推测铝热反应得到的熔融物中还含有 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是_______ (填化学式)。该同学的实验方案是否合理?______ (填“合理”或“不合理”)。理由:_______ (用离子方程式说明)。
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是:
 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
| 物质 | Al |  | Fe |  |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有
 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是
您最近半年使用:0次
2024-01-14更新
|
161次组卷
|
2卷引用:辽宁省部分高中2023-2024学年高一上学期期末考试高化学试题
3 . 如图是部分金属和非金属材料发现和使用的时间简轴。
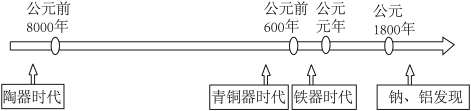
(1)材料的不断发展可以促进社会进步。
①上述金属的常见化合物中,呈淡黄色的是_______ (填化学式)。
②目前应用最多的太阳能电池的光电转化材料是_______ (填化学式)。
③氮化铝(AlN)广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过反应Al2O3+N2+C→AlN+CO合成,配平并用双线桥法标出该反应中电子转移的方向和数目_______ 。
(2)向充满CO2的铝制易拉罐中注入足量的NaOH溶液,立即用胶布封严罐口,罐壁立即内陷,一段时间后,罐壁又重新鼓起来恢复原样。写出易拉罐重新鼓起来时发生反应的化学方程式_______ 。
(3)某同学用下图实验装置探究铁盐与亚铁盐的性质。
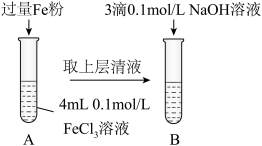
①试管A中发生反应的离子方程式为_______ 。
②试管B中可观察到的现象是_______ 。
(4)“侯氏制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。若制得的纯碱中只含有杂质NaCl,要测定该纯碱的纯度,下列方案可行的是_______ (填字母)。
a.向m g纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b.向m g纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c.准确称量m g样品,加热至恒重,称量得b g固体

(1)材料的不断发展可以促进社会进步。
①上述金属的常见化合物中,呈淡黄色的是
②目前应用最多的太阳能电池的光电转化材料是
③氮化铝(AlN)广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过反应Al2O3+N2+C→AlN+CO合成,配平并用双线桥法标出该反应中电子转移的方向和数目
(2)向充满CO2的铝制易拉罐中注入足量的NaOH溶液,立即用胶布封严罐口,罐壁立即内陷,一段时间后,罐壁又重新鼓起来恢复原样。写出易拉罐重新鼓起来时发生反应的化学方程式
(3)某同学用下图实验装置探究铁盐与亚铁盐的性质。

①试管A中发生反应的离子方程式为
②试管B中可观察到的现象是
(4)“侯氏制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。若制得的纯碱中只含有杂质NaCl,要测定该纯碱的纯度,下列方案可行的是
a.向m g纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b.向m g纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c.准确称量m g样品,加热至恒重,称量得b g固体
您最近半年使用:0次



