解题方法
1 . 富脂食品密封保存往往需要在包装袋内装一小包脱氧剂(有效成分是还原铁粉),某小组为探究脱氧剂中铁粉是否变质,取少量样品溶于稀盐酸,再进行下列实验,下列有关实验现象和结论的说法错误的是
| A.若加盐酸时有气体产生,不能证明脱氧剂未变质 |
| B.若滴加KSCN溶液,无明显变化,再滴加氯水显血红色,则证明脱氧剂未变质 |
| C.若滴加KSCN溶液,溶液显血红色,则证明脱氧剂已变质 |
| D.若加入铜粉充分反应后,溶液呈蓝色,则证明脱氧剂已变质 |
您最近半年使用:0次
2 . 为探究铁和硫反应产物中铁的化合价,某同学设计了如下实验过程:
Fe、S混合粉末 黑色固体
黑色固体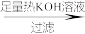 滤渣
滤渣 溶液A
溶液A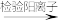 ……
……
已知:①铁和硫反应产物不溶于碱,能溶于硫酸;
②硫可溶于热碱溶液,发生类似Cl2和NaOH溶液的化学反应。
下列说法不正确的是
Fe、S混合粉末
 黑色固体
黑色固体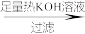 滤渣
滤渣 溶液A
溶液A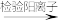 ……
……已知:①铁和硫反应产物不溶于碱,能溶于硫酸;
②硫可溶于热碱溶液,发生类似Cl2和NaOH溶液的化学反应。
下列说法不正确的是
| A.混合粉末应在N2氛围中进行加热,所用H2SO4溶液应先煮沸 |
| B.取溶液A,滴加KSCN溶液,未出现红色,可证明铁和硫反应只有+2价铁生成 |
| C.滤渣用稀H2SO4溶解时应在通风橱中进行 |
D.硫溶于热碱溶液可能发生的离子反应是3S+6OH-  2S2-+ 2S2-+ +3H2O +3H2O |
您最近半年使用:0次
名校
3 . 下列说法中正确的是
| A.元素从化合态变为游离态,该元素一定被还原 |
| B.铝合金比纯铝的熔点更高硬度更大 |
| C.保存FeCl3溶液时,通常在溶液中加少量的单质铁 |
| D.次氯酸钠与碳酸反应生成次氯酸证明次氯酸是弱酸 |
您最近半年使用:0次
名校
解题方法
4 . 工业废水处理是我国环保产业的重要分支。一种处理钢厂酸洗废水(含Fe3+、Fe2+、Al3+等)的工艺流程如下图所示:
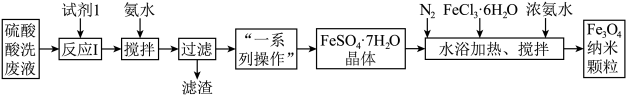
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
回答下列问题:
(1)反应I的离子方程式为___________ 。
(2)加入少量氨水的目的是调节pH,操作时需控制pH值的范围为___________ 。
(3)通入N2的目的是___________ 。
(4)制备Fe3O4纳米颗粒的离子方程式为___________ 。
(5)如何检验硫酸酸洗废液中是否含有Fe2+?___________
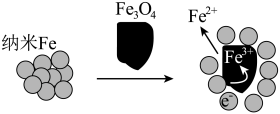
(6)纳米Fe和Fe3O4均可将Cr(Ⅵ)还原为Cr(Ⅲ)从而降解含Cr2O 的酸性废水,实验证明Fe3O4纳米颗粒辅助纳米Fe去除Cr2O
的酸性废水,实验证明Fe3O4纳米颗粒辅助纳米Fe去除Cr2O 的效果更佳,结合下图,分析其原因:
的效果更佳,结合下图,分析其原因:___________ 。
(7)将酸洗废液进行如下实验,检测废液中铁元素含量是否符合国家排放标准。
实验步骤:取100 ml酸洗废液,向其中滴加过量H2O2,微热;用淀粉作指示剂,滴加足量碘化钾至溶液变蓝;最后滴加 0.002 mol/L的硫代硫酸钠溶液至无色,消耗硫代硫酸钠溶液体积为12.7 ml。
已知:I2+2S2O =S4O
=S4O +2I-。废液中铁元素的物质的量浓度为
+2I-。废液中铁元素的物质的量浓度为 ___________ (保留至小数点后两位)。

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应I的离子方程式为
(2)加入少量氨水的目的是调节pH,操作时需控制pH值的范围为
(3)通入N2的目的是
(4)制备Fe3O4纳米颗粒的离子方程式为
(5)如何检验硫酸酸洗废液中是否含有Fe2+?
(6)纳米Fe和Fe3O4均可将Cr(Ⅵ)还原为Cr(Ⅲ)从而降解含Cr2O
 的酸性废水,实验证明Fe3O4纳米颗粒辅助纳米Fe去除Cr2O
的酸性废水,实验证明Fe3O4纳米颗粒辅助纳米Fe去除Cr2O 的效果更佳,结合下图,分析其原因:
的效果更佳,结合下图,分析其原因:
(7)将酸洗废液进行如下实验,检测废液中铁元素含量是否符合国家排放标准。
实验步骤:取100 ml酸洗废液,向其中滴加过量H2O2,微热;用淀粉作指示剂,滴加足量碘化钾至溶液变蓝;最后滴加 0.002 mol/L的硫代硫酸钠溶液至无色,消耗硫代硫酸钠溶液体积为12.7 ml。
已知:I2+2S2O
 =S4O
=S4O +2I-。废液中铁元素的物质的量浓度为
+2I-。废液中铁元素的物质的量浓度为
您最近半年使用:0次
名校
5 . 基础知识填空
(1)目前用途最广、使用量最大的合金是___________ 。
(2)重晶石的化学式为___________ 。
(3)除去 粉末中混有的少量
粉末中混有的少量 所涉及的反应的化学方程式为
所涉及的反应的化学方程式为___________ 。
(4)实验室中制备气体 的化学方程式为
的化学方程式为___________ ; 与氧气在红热的铂丝作用下的化学方程式为
与氧气在红热的铂丝作用下的化学方程式为___________ 。
(5)规范叙述-用实验方法证明某种白色晶体是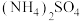
___________ 。
(6)将适量铁粉放入 溶液中,完全反应后,溶液中的
溶液中,完全反应后,溶液中的 和
和 浓度相等。则未反应的
浓度相等。则未反应的 和已反应的
和已反应的 的物质的量之比是
的物质的量之比是___________ 。
(1)目前用途最广、使用量最大的合金是
(2)重晶石的化学式为
(3)除去
 粉末中混有的少量
粉末中混有的少量 所涉及的反应的化学方程式为
所涉及的反应的化学方程式为(4)实验室中制备气体
 的化学方程式为
的化学方程式为 与氧气在红热的铂丝作用下的化学方程式为
与氧气在红热的铂丝作用下的化学方程式为(5)规范叙述-用实验方法证明某种白色晶体是
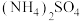
(6)将适量铁粉放入
 溶液中,完全反应后,溶液中的
溶液中,完全反应后,溶液中的 和
和 浓度相等。则未反应的
浓度相等。则未反应的 和已反应的
和已反应的 的物质的量之比是
的物质的量之比是
您最近半年使用:0次
6 . 铁及其化合物在日常生产生活中有着广泛应用。
I.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知:Fe3O4中Fe的化合价为+2价、+3价)。
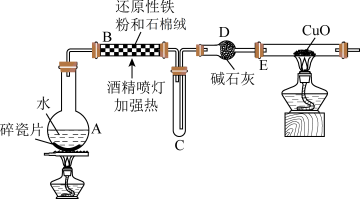
(1)装置B中发生反应的化学方程式为___________ 。
(2)装置C中导管“短进长出”的原因___________ 。
(3)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液没有出现红色,原因是___________ (用离子方程式表示)。
II.某学生设计了如图装置制备白色Fe(OH)2固体。
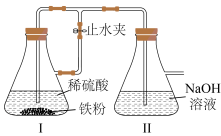
(4)开始实验时,先打开止水夹,待装置中空气已排尽,再关闭止水夹。
①关闭止水夹前,如何证明装置中空气已排尽:___________ 。
②装置II中发生反应的主要化学方程式为___________ 。
③若未排净装置中的空气,则装置II中观察到的实验现象为___________ 。
I.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知:Fe3O4中Fe的化合价为+2价、+3价)。

(1)装置B中发生反应的化学方程式为
(2)装置C中导管“短进长出”的原因
(3)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液没有出现红色,原因是
II.某学生设计了如图装置制备白色Fe(OH)2固体。

(4)开始实验时,先打开止水夹,待装置中空气已排尽,再关闭止水夹。
①关闭止水夹前,如何证明装置中空气已排尽:
②装置II中发生反应的主要化学方程式为
③若未排净装置中的空气,则装置II中观察到的实验现象为
您最近半年使用:0次
名校
7 .  是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
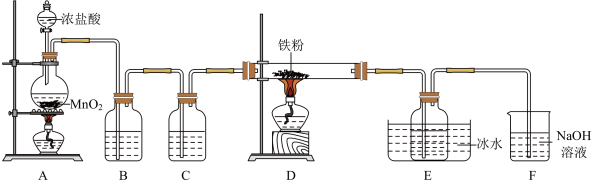
已知:① 易升华、遇水蒸气易潮解。
易升华、遇水蒸气易潮解。
②实验室用铁氰化钾{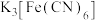 }溶液检验
}溶液检验 ,产生蓝色沉淀。
,产生蓝色沉淀。
回答下列问题:
(1)盛装浓盐酸的仪器是__________ (填名称),装置B中的试剂是__________ 。
(2)装置A中发生反应的化学方程式为__________ 。
(3)装置E中冰水浴的作用是__________ 。
(4)上述实验装置存在两处缺陷导致产品产率偏低,解决方案是:一是加租制备产品的导气管,防堵塞;二是__________ 。
(5)对实验装置进行改进后,继续完成实验。实验完毕后,取产品探究其性质:
根据上述实验现象,不能确定产品中是否剩余铁单质,理由是__________ (用离子方程式表示)。为了确认产品中是否剩余铁单质,取上述实验②所得溶液于试管中,__________ (补充步骤和现象),则证明产品中剩余铁单质。
 是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
已知:①
 易升华、遇水蒸气易潮解。
易升华、遇水蒸气易潮解。②实验室用铁氰化钾{
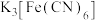 }溶液检验
}溶液检验 ,产生蓝色沉淀。
,产生蓝色沉淀。回答下列问题:
(1)盛装浓盐酸的仪器是
(2)装置A中发生反应的化学方程式为
(3)装置E中冰水浴的作用是
(4)上述实验装置存在两处缺陷导致产品产率偏低,解决方案是:一是加租制备产品的导气管,防堵塞;二是
(5)对实验装置进行改进后,继续完成实验。实验完毕后,取产品探究其性质:
实验 | 操作 | 现象 |
① | 取少量固体溶于蒸馏水,滴加KSCN溶液 | 溶液变红色 |
② | 取少量固体溶于稀硫酸 | 固体溶解,无气泡产生 |
您最近半年使用:0次
8 . Ⅰ.钠、铝、铁是三种重要的金属,它们的单质及其化合物在生活生产中有重要的作用。请回答下列问题:
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:_______ ,该反应中氧化剂和还原剂的物质的量之比为______ 。
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是: 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
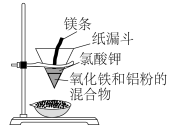
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ (填化学式),该试剂与金属铝反应的离子方程式为_______ 。
(3)另一同学推测铝热反应得到的熔融物中还含有 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是_______ (填化学式)。该同学的实验方案是否合理?______ (填“合理”或“不合理”)。理由:_______ (用离子方程式说明)。
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是:
 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
| 物质 | Al |  | Fe |  |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有
 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是
您最近半年使用:0次
2024-01-14更新
|
161次组卷
|
2卷引用:辽宁省部分高中2023-2024学年高一上学期期末考试高化学试题
名校
9 . 向盛有5mL0.005mol/LFeCl3溶液的试管中加入5mL0.015mol/LKSCN溶液,观察现象。将上述溶液平均分装在a、b、c三支试管中,向试管b中加入少量铁粉,向试管c中滴加vmLxmol/LKSCN溶液,观察试管b、c中溶液颜色的变化,并均与试管a对比。下列说法正确的是
| A.FeCl3溶液和KSCN溶液可以产生红色沉淀 |
| B.b试管中的现象说明:当其他条件不变时,增大生成物浓度平衡向逆反应方向移动 |
| C.为了证明其他条件不变时,增大反应物的浓度平衡向正反应方向移动,则x应该尽可能的大,而v应该尽可能的小 |
| D.若向试管a中加入4滴1mol/L的KCl溶液,溶液颜色会变深 |
您最近半年使用:0次
2023-11-09更新
|
141次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
10 . 高铁酸钠(Na2FeO4)是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取Na2FeO4并回收金属Cu,工艺流程如下:
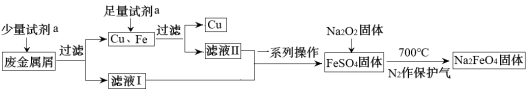
(1)试剂a为___________ (填化学式)。
(2)证明滤液I中无Fe3+的实验方法是___________ ;用离子方程式解释滤液I不含有Fe3+可能的原因___________ 。
(3)流程中Na2O2不可暴露在空气中时间过长,原因是___________ (用化学方程式表示)。
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中___________ 作还原剂;每生成1mol Na2FeO4转移的电子数为___________ 。
(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为____________ ,配平该化学方程式,化学计量数从左至右分别为___________ 。
(6)用Na2FeO4代替Cl2处理饮用水的优点是___________ (只答一条即可)。

(1)试剂a为
(2)证明滤液I中无Fe3+的实验方法是
(3)流程中Na2O2不可暴露在空气中时间过长,原因是
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2
 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为
(6)用Na2FeO4代替Cl2处理饮用水的优点是
您最近半年使用:0次



