解题方法
1 . 富脂食品密封保存往往需要在包装袋内装一小包脱氧剂(有效成分是还原铁粉),某小组为探究脱氧剂中铁粉是否变质,取少量样品溶于稀盐酸,再进行下列实验,下列有关实验现象和结论的说法错误的是
| A.若加盐酸时有气体产生,不能证明脱氧剂未变质 |
| B.若滴加KSCN溶液,无明显变化,再滴加氯水显血红色,则证明脱氧剂未变质 |
| C.若滴加KSCN溶液,溶液显血红色,则证明脱氧剂已变质 |
| D.若加入铜粉充分反应后,溶液呈蓝色,则证明脱氧剂已变质 |
您最近一年使用:0次
名校
解题方法
2 . 铁是人类使用最早的金属之一。运用所学知识,回答下列问题:
(1)电子工业用FeCl3,溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的化学方程式为______ 。
(2)某研究性学习小组为测定FeCl3溶液腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子有______ 。
②验证该溶液中是否含有Fe2+,正确的实验方法是______ (填序号)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液先滴入双氧水再滴入KSCN溶液,若溶液显红色,证明原溶液中含有Fe2+
D.取适量溶液,滴入K3[Fe(CN)6]溶液,若产生蓝色沉淀,证明含有Fe2+
(3)工程师欲从制造印刷电路板的废液中回收铜,并获得FeCl3,溶液,设计如下方案:______ 。
②向滤液B和滤液E中通入F的目的是______ ,该反应的离子方程式为______ 。
③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是______ (填序号)。
A.有铜单质剩余但无铁单质剩余 B.有铁单质剩余但无铜单质剩余
C.铁、铜单质都有剩余 D.铁、铜单质都无剩余
(1)电子工业用FeCl3,溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的化学方程式为
(2)某研究性学习小组为测定FeCl3溶液腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子有
②验证该溶液中是否含有Fe2+,正确的实验方法是
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液先滴入双氧水再滴入KSCN溶液,若溶液显红色,证明原溶液中含有Fe2+
D.取适量溶液,滴入K3[Fe(CN)6]溶液,若产生蓝色沉淀,证明含有Fe2+
(3)工程师欲从制造印刷电路板的废液中回收铜,并获得FeCl3,溶液,设计如下方案:
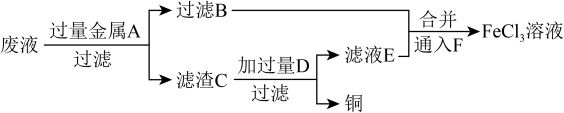
②向滤液B和滤液E中通入F的目的是
③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.有铜单质剩余但无铁单质剩余 B.有铁单质剩余但无铜单质剩余
C.铁、铜单质都有剩余 D.铁、铜单质都无剩余
您最近一年使用:0次
名校
3 .  是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
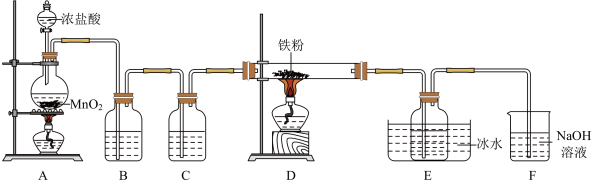
已知:① 易升华、遇水蒸气易潮解。
易升华、遇水蒸气易潮解。
②实验室用铁氰化钾{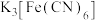 }溶液检验
}溶液检验 ,产生蓝色沉淀。
,产生蓝色沉淀。
回答下列问题:
(1)盛装浓盐酸的仪器是__________ (填名称),装置B中的试剂是__________ 。
(2)装置A中发生反应的化学方程式为__________ 。
(3)装置E中冰水浴的作用是__________ 。
(4)上述实验装置存在两处缺陷导致产品产率偏低,解决方案是:一是加租制备产品的导气管,防堵塞;二是__________ 。
(5)对实验装置进行改进后,继续完成实验。实验完毕后,取产品探究其性质:
根据上述实验现象,不能确定产品中是否剩余铁单质,理由是__________ (用离子方程式表示)。为了确认产品中是否剩余铁单质,取上述实验②所得溶液于试管中,__________ (补充步骤和现象),则证明产品中剩余铁单质。
 是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
已知:①
 易升华、遇水蒸气易潮解。
易升华、遇水蒸气易潮解。②实验室用铁氰化钾{
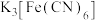 }溶液检验
}溶液检验 ,产生蓝色沉淀。
,产生蓝色沉淀。回答下列问题:
(1)盛装浓盐酸的仪器是
(2)装置A中发生反应的化学方程式为
(3)装置E中冰水浴的作用是
(4)上述实验装置存在两处缺陷导致产品产率偏低,解决方案是:一是加租制备产品的导气管,防堵塞;二是
(5)对实验装置进行改进后,继续完成实验。实验完毕后,取产品探究其性质:
实验 | 操作 | 现象 |
① | 取少量固体溶于蒸馏水,滴加KSCN溶液 | 溶液变红色 |
② | 取少量固体溶于稀硫酸 | 固体溶解,无气泡产生 |
您最近一年使用:0次
名校
解题方法
4 . 高铁酸钠(Na2FeO4)是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取Na2FeO4并回收金属Cu,工艺流程如下:
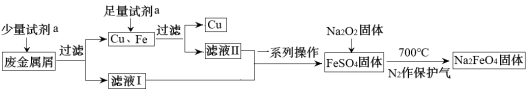
(1)试剂a为___________ (填化学式)。
(2)证明滤液I中无Fe3+的实验方法是___________ ;用离子方程式解释滤液I不含有Fe3+可能的原因___________ 。
(3)流程中Na2O2不可暴露在空气中时间过长,原因是___________ (用化学方程式表示)。
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中___________ 作还原剂;每生成1mol Na2FeO4转移的电子数为___________ 。
(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为____________ ,配平该化学方程式,化学计量数从左至右分别为___________ 。
(6)用Na2FeO4代替Cl2处理饮用水的优点是___________ (只答一条即可)。

(1)试剂a为
(2)证明滤液I中无Fe3+的实验方法是
(3)流程中Na2O2不可暴露在空气中时间过长,原因是
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2
 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为
(6)用Na2FeO4代替Cl2处理饮用水的优点是
您最近一年使用:0次
名校
解题方法
5 . 印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol/L,FeCl2 3.0 mol/L,FeCl3 1.0 mol/L,HCl 3.0 mol/L。取废腐蚀液200 mL按如下流程在实验室进行实验:

回答下列问题:
(1)取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液显_______ (填“红色”或“蓝色”、“紫色”),证明废液含有FeCl3。
(2)上述方法获得的铜粉中含有杂质,除杂所需试剂是_______ (填化学式)。
(3)操作Ⅰ是_______ ,该操作需用到的玻璃仪器有烧杯、普通漏斗和_______ 。
(4)FeCl2溶液中通入氯气,发生反应的离子方程式为_______ 。
(5)已知氧化性:Fe3+>Cu2+ >H+>Fe2+;往上述200 mL废腐蚀液中加入20g铁粉,边加边搅拌,是否有氢气产生_______ (填“是”、“否”)。

回答下列问题:
(1)取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液显
(2)上述方法获得的铜粉中含有杂质,除杂所需试剂是
(3)操作Ⅰ是
(4)FeCl2溶液中通入氯气,发生反应的离子方程式为
(5)已知氧化性:Fe3+>Cu2+ >H+>Fe2+;往上述200 mL废腐蚀液中加入20g铁粉,边加边搅拌,是否有氢气产生
您最近一年使用:0次
解题方法
6 . 某工厂废水中含大量 和少量的
和少量的 、
、 、
、 ,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):
,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):

(1)“试剂Ⅱ”为_______ ,与“试剂Ⅰ”反应的离子有_______
(2)“红褐色沉淀”为_______ ,“ ”的作用是
”的作用是_______
(3)“试剂Ⅲ”是沉淀“溶液B”中 ,证明“溶液B”中
,证明“溶液B”中 已经完全沉淀的试剂为
已经完全沉淀的试剂为_______ 。
(4)“溶液B”中残留 与“试剂Ⅲ”反应的化学方程式为
与“试剂Ⅲ”反应的化学方程式为_______ 。
(5)“溶液C”在空气中晾晒一段时间后,加盐酸调成弱酸性,蒸发可得工业食盐,但加盐酸时有少量气泡逸出,经检验为 ,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)
,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)_______
 和少量的
和少量的 、
、 、
、 ,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):
,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):
(1)“试剂Ⅱ”为
(2)“红褐色沉淀”为
 ”的作用是
”的作用是(3)“试剂Ⅲ”是沉淀“溶液B”中
 ,证明“溶液B”中
,证明“溶液B”中 已经完全沉淀的试剂为
已经完全沉淀的试剂为(4)“溶液B”中残留
 与“试剂Ⅲ”反应的化学方程式为
与“试剂Ⅲ”反应的化学方程式为(5)“溶液C”在空气中晾晒一段时间后,加盐酸调成弱酸性,蒸发可得工业食盐,但加盐酸时有少量气泡逸出,经检验为
 ,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)
,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)
您最近一年使用:0次
2022-01-17更新
|
697次组卷
|
2卷引用:四川省达州市2021-2022学年高一上学期期末监测化学试题
7 . (1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如图所示。写出该氧化还原反应的离子方程式:___________ 。该装置中的负极材料是___________ (填化学式),正极反应式是___________ 。

(2)某研究性学习小组为证明 为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。
为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。
方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,滴入5滴稀盐酸,再继续加入2mLCCl4,充分振荡、静置、分层,取上层清液,滴加KSCN溶液,现象是___________ ,即可证明该反应为可逆反应。你认为此方案___________ (“不严密”或“严密”),理由是___________ (用离子方程式表示)。
方案二:设计如图原电池装置,接通灵敏电流计,指针向右偏转,随着反应时间进行;电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右边的池了中加入1mol/L FeCl2溶液,灵敏电流计指针向左偏转,即可证明该反应为可逆反应。你认为灵敏电流计“读数变为零”的原因是___________ 。


(2)某研究性学习小组为证明
 为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。
为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,滴入5滴稀盐酸,再继续加入2mLCCl4,充分振荡、静置、分层,取上层清液,滴加KSCN溶液,现象是
方案二:设计如图原电池装置,接通灵敏电流计,指针向右偏转,随着反应时间进行;电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右边的池了中加入1mol/L FeCl2溶液,灵敏电流计指针向左偏转,即可证明该反应为可逆反应。你认为灵敏电流计“读数变为零”的原因是

您最近一年使用:0次
解题方法
8 . 电子工业常用FeCl3溶液腐蚀印刷电路板上的铜箔。某研究小组设计以下流程从腐蚀废液中回收铜,并重新获得FeCl3溶液。

(1)FeCl3溶液腐蚀铜箔的离子方程式为___ 。
(2)试剂①为___ (写化学式),试剂②需过量的原因是___ 。
(3)证明“滤液”中不含Fe3+的方法为___ 。
(4)“反应”步骤中的离子方程式为___ 。
(5)向沸水中加入1mol•L-1FeCl3溶液至液体呈透明的红褐色,该分散系具有的独特性质是___ (写出一条)。

(1)FeCl3溶液腐蚀铜箔的离子方程式为
(2)试剂①为
(3)证明“滤液”中不含Fe3+的方法为
(4)“反应”步骤中的离子方程式为
(5)向沸水中加入1mol•L-1FeCl3溶液至液体呈透明的红褐色,该分散系具有的独特性质是
您最近一年使用:0次
2021-01-28更新
|
190次组卷
|
2卷引用:河南省郑州市2020-2021学年高一上学期期末考试化学试题
解题方法
9 . FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)_______ 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。完成NaClO3氧化FeCl2的离子方程式:_______
某化学研究性学习小组探究Fe3+和 之间发生的反应
之间发生的反应
(3)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为_______ 。
(4)研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
(方案一)检验溶液中含有Fe2+证明发生了氧化还原反应
(方案二)检验溶液中含有_______ 证明发生了氧化还原反应
Ⅰ.预处理:将(方案一)中获得的混合物放在如图装置中处理足够时间。

Ⅱ.检验过程
①简述证明溶液中含有Fe2+的操作方法及现象:_______ ;
②检验溶液中含有另一种离子可选用的试剂是:_______ 。
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。完成NaClO3氧化FeCl2的离子方程式:
某化学研究性学习小组探究Fe3+和
 之间发生的反应
之间发生的反应(3)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为
(4)研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
(方案一)检验溶液中含有Fe2+证明发生了氧化还原反应
(方案二)检验溶液中含有
Ⅰ.预处理:将(方案一)中获得的混合物放在如图装置中处理足够时间。

Ⅱ.检验过程
①简述证明溶液中含有Fe2+的操作方法及现象:
②检验溶液中含有另一种离子可选用的试剂是:
您最近一年使用:0次
解题方法
10 . 下列说法中不正确的是
| A.赤铁矿的主要成分与铁锈的主要成分相同 |
| B.Fe3O4可由单质直接化合而得到 |
| C.FeCl2、FeCl3、Fe(OH)3都可通过化合反应生成 |
| D.某溶液中滴加氯水,然后滴加KSCN溶液,溶液显红色,该溶液中一定含有Fe2+ |
您最近一年使用:0次



