名校
1 . 某化学兴趣小组利用废铁屑(含少量 )制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
)制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。

请回答下列问题:
(1)“酸溶”时,搅拌的目的是_______ 。
(2)“操作Y”为_______ (填操作名称),经过“操作Y”得到了滤渣 ,则物质X可用于除去过量的稀硫酸和防止
,则物质X可用于除去过量的稀硫酸和防止 被氧化,可选择
被氧化,可选择_______ (填试剂名称),“转化2”发生反应的离子方程式为_______ 。
(3)“洗涤”时,能证明滤渣洗涤干净的操作及现象为_______ 。
(4)麦片中常添加微量还原性铁粉,用于补充入体所需的铁元素,这些铁粉在胃酸(主要成分为盐酸)的作用下发生反应变成人体容易吸收的铁元素,发生反应的化学方程式为_______ ;人体补铁时,同时服用维生素C能促进亚铁离子被吸收,说明维生素C具有_______ (填“氧化性”或“还原性”)。
 )制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
)制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
请回答下列问题:
(1)“酸溶”时,搅拌的目的是
(2)“操作Y”为
 ,则物质X可用于除去过量的稀硫酸和防止
,则物质X可用于除去过量的稀硫酸和防止 被氧化,可选择
被氧化,可选择(3)“洗涤”时,能证明滤渣洗涤干净的操作及现象为
(4)麦片中常添加微量还原性铁粉,用于补充入体所需的铁元素,这些铁粉在胃酸(主要成分为盐酸)的作用下发生反应变成人体容易吸收的铁元素,发生反应的化学方程式为
您最近一年使用:0次
2022-12-07更新
|
229次组卷
|
4卷引用:四川省成都市四校2022-2023学年高一上学期12月联考化学试题
四川省成都市四校2022-2023学年高一上学期12月联考化学试题四川省眉山市彭山区第一中学2022-2023学年高一上学期第二次模拟选科调考化学试题云南省楚雄彝族自治州2022-2023学年高一上学期期末教育学业质量监测化学试题(已下线)第13讲 铁和铁的氧化物-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)
名校
解题方法
2 . 为不断满足人民群众对美好生活的需要,水资源保护已经成为我国生态建设的重要领域。水处理技术的目的在于使废水经过技术处理后达到再次使用或者排放的水质要求,被广泛应用于工业、农业、环保、餐饮等各个行业,与人们的日常生活密切相关。经检测,某工厂的酸性废水中所含离子及其浓度如下表所示:
回答下列问题:
Ⅰ.
(1)该工业废水中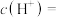
___________  。
。
Ⅱ.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾( )。
)。
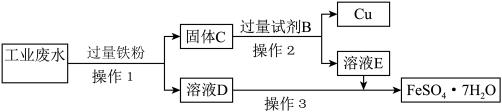
(2)在实验室完成操作1,需用到的玻璃仪器除烧杯、玻璃棒外,还有___________ 。
(3)工业废水中加入铁粉后,反应的离子方程式为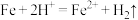 、
、___________ 、___________ 。
(4)试剂B是___________ 。
(5)操作3是蒸发浓缩、___________ 、过滤,最后用少量冷水洗涤晶体,在低温下干燥。
(6)证明溶液E中只含有 而不含
而不含 的实验方法:取少量溶液E于试管中,
的实验方法:取少量溶液E于试管中,___________ (填字母)。
a.先加氯水,再加KSCN溶液后显红色
b.先加KSCN溶液,不显红色,再加氯水后显红色
c.滴加NaOH溶液,只产生白色沉淀,且白色沉淀迅速变为灰绿色,最后呈红褐色
| 离子 |  |  |  |  |  |
浓度/( ) ) | 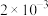 | 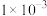 | 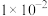 | 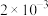 |
Ⅰ.
(1)该工业废水中
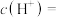
 。
。Ⅱ.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(
 )。
)。
(2)在实验室完成操作1,需用到的玻璃仪器除烧杯、玻璃棒外,还有
(3)工业废水中加入铁粉后,反应的离子方程式为
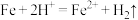 、
、(4)试剂B是
(5)操作3是蒸发浓缩、
(6)证明溶液E中只含有
 而不含
而不含 的实验方法:取少量溶液E于试管中,
的实验方法:取少量溶液E于试管中,a.先加氯水,再加KSCN溶液后显红色
b.先加KSCN溶液,不显红色,再加氯水后显红色
c.滴加NaOH溶液,只产生白色沉淀,且白色沉淀迅速变为灰绿色,最后呈红褐色
您最近一年使用:0次
2023-04-23更新
|
257次组卷
|
2卷引用:贵州省铜仁市2022-2023学年高一上学期期末考试化学试题
解题方法
3 . 下列实验的“操作和现象”与“推测或结论”对应关系正确的是
选项 | 操作和现象 | 推测或结论 |
A | 向H2O2溶液中加入几滴FeCl3溶液,溶液中产生气泡 | 发生的离子反应为: |
B | 用铁丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液含有钠盐 |
C | 向Al与Fe2O3反应后的固体产物中先加稀硫酸溶解,再加入几滴KSCN溶液,溶液不变红 | 无法证明反应后固体产物中是否含有Fe2O3 |
D | 向无水乙醇中加入浓硫酸,加热至170℃,将产生的气体通入酸性高锰酸钾溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 高铁酸钠(Na2FeO4)是一种多功能绿色水处理剂,杀菌消毒的同时可生成氢氧化铁胶体。某工厂利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取Na2FeO4并回收金属Cu,工艺流程如下:
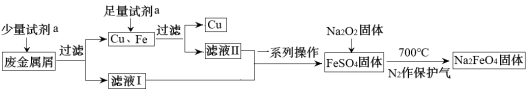
(1)试剂a为___________ (填化学式)。
(2)证明滤液I中无Fe3+的实验方法是___________ ;用离子方程式解释滤液I不含有Fe3+可能的原因___________ 。
(3)流程中Na2O2不可暴露在空气中时间过长,原因是___________ (用化学方程式表示)。
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中___________ 作还原剂;每生成1mol Na2FeO4转移的电子数为___________ 。
(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为____________ ,配平该化学方程式,化学计量数从左至右分别为___________ 。
(6)用Na2FeO4代替Cl2处理饮用水的优点是___________ (只答一条即可)。

(1)试剂a为
(2)证明滤液I中无Fe3+的实验方法是
(3)流程中Na2O2不可暴露在空气中时间过长,原因是
(4)制备Na2FeO4的原理:2FeSO4+6Na2O2
 2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中
2Na2FeO4+2Na2O+2Na2SO4+O2↑。反应中(5)Na2FeO4净水过程中所发生的化学反应主要为:▢Na2FeO4+▢H2O→▢Fe(OH)3(胶体)+▢NaOH+▢X↑,请推测X的化学式为
(6)用Na2FeO4代替Cl2处理饮用水的优点是
您最近一年使用:0次
名校
解题方法
5 . 印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol/L,FeCl2 3.0 mol/L,FeCl3 1.0 mol/L,HCl 3.0 mol/L。取废腐蚀液200 mL按如下流程在实验室进行实验:

回答下列问题:
(1)取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液显_______ (填“红色”或“蓝色”、“紫色”),证明废液含有FeCl3。
(2)上述方法获得的铜粉中含有杂质,除杂所需试剂是_______ (填化学式)。
(3)操作Ⅰ是_______ ,该操作需用到的玻璃仪器有烧杯、普通漏斗和_______ 。
(4)FeCl2溶液中通入氯气,发生反应的离子方程式为_______ 。
(5)已知氧化性:Fe3+>Cu2+ >H+>Fe2+;往上述200 mL废腐蚀液中加入20g铁粉,边加边搅拌,是否有氢气产生_______ (填“是”、“否”)。

回答下列问题:
(1)取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液显
(2)上述方法获得的铜粉中含有杂质,除杂所需试剂是
(3)操作Ⅰ是
(4)FeCl2溶液中通入氯气,发生反应的离子方程式为
(5)已知氧化性:Fe3+>Cu2+ >H+>Fe2+;往上述200 mL废腐蚀液中加入20g铁粉,边加边搅拌,是否有氢气产生
您最近一年使用:0次
名校
6 . 下列实验内容可以达到预期实验目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 将1 mol 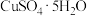 溶解在1 L水中 溶解在1 L水中 | 配制1  的 的 溶液 溶液 |
| B | 将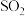 通入酸性 通入酸性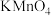 溶液中 溶液中 | 证明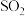 具有漂白性 具有漂白性 |
| C | 加入足量铁屑,充分反应后,过滤 | 除去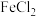 溶液中的少量 溶液中的少量 |
| D | 将木炭与浓硫酸共热,得到的气体通入澄清石灰水 | 检验木炭的氧化产物是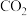 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-16更新
|
240次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2021-2022学年高三上学期期中考试化学试题
7 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验氯气输送管道是否漏气 | 在管道边喷洒浓氨水进行检验 | 若有氯气泄漏,则会在泄漏处附近产生白烟 |
| B | 探究金属铁在氯气中燃烧所得固体粉末的成分 | 取少量固体粉末加入5-7mL蒸馏水,振荡,迅速滴入5滴15%KSCN溶液 | 若溶液无红色,则固体粉末不为FeCl3 |
| C | 验证H2S与HI的酸性强弱 | 将AgI固体加入水中,再向其中滴入几滴H2S溶液 | 固体由黄色变为黑色,说明有Ag2S沉淀和HI生成,证明H2S酸性更强 |
| D | 验证NO2是一种酸性氧化物 | 将NO2通入蒸馏水中,检测反应所得溶液的pH | 红棕色气体溶于水得无色溶液,所得溶液的pH小于7,同时有无色气体产生,说明反应生成了HNO3和NO,由此证明NO2是酸性氧化物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 某工厂废水中含大量 和少量的
和少量的 、
、 、
、 ,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):
,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):

(1)“试剂Ⅱ”为_______ ,与“试剂Ⅰ”反应的离子有_______
(2)“红褐色沉淀”为_______ ,“ ”的作用是
”的作用是_______
(3)“试剂Ⅲ”是沉淀“溶液B”中 ,证明“溶液B”中
,证明“溶液B”中 已经完全沉淀的试剂为
已经完全沉淀的试剂为_______ 。
(4)“溶液B”中残留 与“试剂Ⅲ”反应的化学方程式为
与“试剂Ⅲ”反应的化学方程式为_______ 。
(5)“溶液C”在空气中晾晒一段时间后,加盐酸调成弱酸性,蒸发可得工业食盐,但加盐酸时有少量气泡逸出,经检验为 ,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)
,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)_______
 和少量的
和少量的 、
、 、
、 ,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):
,为减少污染变废为宝,实验小组设计了如图方案(其中每步加入试剂均过量):
(1)“试剂Ⅱ”为
(2)“红褐色沉淀”为
 ”的作用是
”的作用是(3)“试剂Ⅲ”是沉淀“溶液B”中
 ,证明“溶液B”中
,证明“溶液B”中 已经完全沉淀的试剂为
已经完全沉淀的试剂为(4)“溶液B”中残留
 与“试剂Ⅲ”反应的化学方程式为
与“试剂Ⅲ”反应的化学方程式为(5)“溶液C”在空气中晾晒一段时间后,加盐酸调成弱酸性,蒸发可得工业食盐,但加盐酸时有少量气泡逸出,经检验为
 ,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)
,则“溶液C”中碳酸盐形成的可能离子反应为(写出一个即可)
您最近一年使用:0次
2022-01-17更新
|
697次组卷
|
2卷引用:四川省达州市2021-2022学年高一上学期期末监测化学试题
9 . (1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如图所示。写出该氧化还原反应的离子方程式:___________ 。该装置中的负极材料是___________ (填化学式),正极反应式是___________ 。

(2)某研究性学习小组为证明 为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。
为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。
方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,滴入5滴稀盐酸,再继续加入2mLCCl4,充分振荡、静置、分层,取上层清液,滴加KSCN溶液,现象是___________ ,即可证明该反应为可逆反应。你认为此方案___________ (“不严密”或“严密”),理由是___________ (用离子方程式表示)。
方案二:设计如图原电池装置,接通灵敏电流计,指针向右偏转,随着反应时间进行;电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右边的池了中加入1mol/L FeCl2溶液,灵敏电流计指针向左偏转,即可证明该反应为可逆反应。你认为灵敏电流计“读数变为零”的原因是___________ 。


(2)某研究性学习小组为证明
 为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。
为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,滴入5滴稀盐酸,再继续加入2mLCCl4,充分振荡、静置、分层,取上层清液,滴加KSCN溶液,现象是
方案二:设计如图原电池装置,接通灵敏电流计,指针向右偏转,随着反应时间进行;电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右边的池了中加入1mol/L FeCl2溶液,灵敏电流计指针向左偏转,即可证明该反应为可逆反应。你认为灵敏电流计“读数变为零”的原因是

您最近一年使用:0次
10 . 下列有关实验操作、现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 向溶液中加入少量酸性高锰酸钾溶液 | 紫色褪去 | 可证明溶液中不含Fe3+,可能含有Fe2+ |
| C | Fe放入冷的浓硫酸中 | 无现象 | 铁不与浓硫酸反应 |
| D | 向硫酸亚铁溶液中加入氯水,再加入KSCN溶液 | 溶液变为红色 | 不能说明硫酸亚铁溶液中存在Fe3+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-15更新
|
239次组卷
|
2卷引用:陕西省咸阳市泾阳县2021-2022学年高三上学期期中考试化学试题




