1 . Ⅰ.某工厂的酸性废水中主要含有 、
、 等离子,为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾 (
等离子,为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾 ( )。
)。
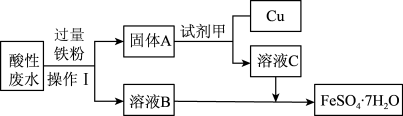
(1)操作Ⅰ是_______ ;试剂甲是_______ (填化学式)。
(2)获得的 需密闭保存,原因是
需密闭保存,原因是_______ 。
(3)绿矾可消除某种酸性工业废水中+6价铬( )的污染,使之转化为毒性较小的
)的污染,使之转化为毒性较小的 ,该反应的离子方程式是
,该反应的离子方程式是_______ 。
(4)黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是_______ 。
Ⅱ.某小组为探究 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。氧化性强弱探究:
【分析与解释】
(5)实验Ⅰ中a试管中反应的离子方程式是_______ 。
(6)①甲同学认为:实验Ⅱ观察到_______ 现象,得出氧化性 。
。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性 ;他补做了实验Ⅲ。补做实验Ⅲ的目的是
;他补做了实验Ⅲ。补做实验Ⅲ的目的是_______ 。
 、
、 等离子,为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾 (
等离子,为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾 ( )。
)。
(1)操作Ⅰ是
(2)获得的
 需密闭保存,原因是
需密闭保存,原因是(3)绿矾可消除某种酸性工业废水中+6价铬(
 )的污染,使之转化为毒性较小的
)的污染,使之转化为毒性较小的 ,该反应的离子方程式是
,该反应的离子方程式是(4)黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是
Ⅱ.某小组为探究
 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。氧化性强弱探究:
| 实验Ⅰ | 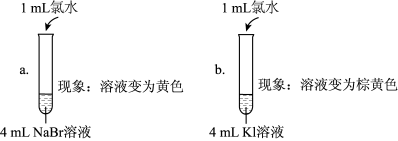 |
| 实验Ⅱ | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
| 实验Ⅲ | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
(5)实验Ⅰ中a试管中反应的离子方程式是
(6)①甲同学认为:实验Ⅱ观察到
 。
。②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性
 ;他补做了实验Ⅲ。补做实验Ⅲ的目的是
;他补做了实验Ⅲ。补做实验Ⅲ的目的是
您最近半年使用:0次
名校
解题方法
2 . 某兴趣小组利用下列试剂:铁粉、锌粉、0.1mol/L 溶液、0.1mol/L
溶液、0.1mol/L 溶液、KSCN溶液、新制氯水,探究
溶液、KSCN溶液、新制氯水,探究 、
、 的氧化性、还原性,并利用实验结论解决一些问题。
的氧化性、还原性,并利用实验结论解决一些问题。
(1)用所给试剂写出体现 具有还原性的反应的离子反应方程式:
具有还原性的反应的离子反应方程式:___________ 。
(2)设计实验方案,完成下列表格。
(3)该兴趣小组未说明“ 具有氧化性”,提出了向
具有氧化性”,提出了向 溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为
溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为___________ 。
(4)已知:酸性 可将
可将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ ,该反应中氧化产物是___________ (写离子符号)。
 溶液、0.1mol/L
溶液、0.1mol/L 溶液、KSCN溶液、新制氯水,探究
溶液、KSCN溶液、新制氯水,探究 、
、 的氧化性、还原性,并利用实验结论解决一些问题。
的氧化性、还原性,并利用实验结论解决一些问题。(1)用所给试剂写出体现
 具有还原性的反应的离子反应方程式:
具有还原性的反应的离子反应方程式:(2)设计实验方案,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 |
探究 的化学性质 的化学性质 | 取少量0.1mol/L 溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液变成 |
结论: 具有 具有 | ||
 具有氧化性”,提出了向
具有氧化性”,提出了向 溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为
溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为(4)已知:酸性
 可将
可将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为
您最近半年使用:0次
3 . 为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且完全正确的是
| 选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
| A | 在氯化亚铁溶液中滴加新制氯水 | 浅绿色溶液变成棕黄色溶液 |  |  具有还原性 具有还原性 |
| B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 |  |  具有氧化性 具有氧化性 |
| C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | 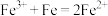 | 铁单质具有还原性 |
| D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 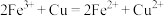 |  具有氧化性 具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
4 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的机化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成。
①写出3种含有不同价态铁元素的物质,并标出铁元素的化合价:__________ 、__________ 、__________ 。
②写出①中所列物质之间相互转化(含三种价态)的化学方程式:_______ 。
(2)利用实验室中提供的试剂:锌粒、铁粉、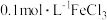 溶液、
溶液、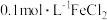 溶液、KSCN溶液、新制氯水,来探究
溶液、KSCN溶液、新制氯水,来探究 、
、 的氧化性、还原性。
的氧化性、还原性。
根据氧化还原反应的原理,小明认为 既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。
既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。
(1)课前老师布置了下列预习作业,请你一起完成。
①写出3种含有不同价态铁元素的物质,并标出铁元素的化合价:
②写出①中所列物质之间相互转化(含三种价态)的化学方程式:
(2)利用实验室中提供的试剂:锌粒、铁粉、
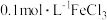 溶液、
溶液、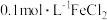 溶液、KSCN溶液、新制氯水,来探究
溶液、KSCN溶液、新制氯水,来探究 、
、 的氧化性、还原性。
的氧化性、还原性。根据氧化还原反应的原理,小明认为
 既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。
既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。| 探究内容 | 实验方案 | 实验现象 |
 具有还原性 具有还原性 | 取少量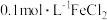 溶液,加入足量 溶液,加入足量 | 溶液变成红色 |
 具有氧化性 具有氧化性 | 取少量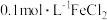 溶液,加入 溶液,加入 | 溶液由浅绿色变成无色,所发生反应的离子方程式为 |
您最近半年使用:0次
5 . 某地轮胎厂排出的酸性废水中主要含有K+、Cu2+、Fe2+、 ,某学校化学兴趣小组同学设计如图方案将该酸性废水变废为宝。
,某学校化学兴趣小组同学设计如图方案将该酸性废水变废为宝。
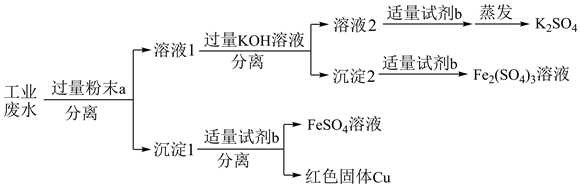
已知:Fe(OH)2在空气中难以稳定存在,极易被氧化为Fe(OH)3
回答下列问题:
(1)粉末a的成分为___________ (填化学式),分离溶液1和沉淀1的操作的名称为___________ ,写出加入的粉末a与Cu2+反应的离子方程式并用双线桥法标明电子转移情况:___________
(2)试剂b为___________ (填化学式,下同),沉淀2为___________
(3)试剂b与沉淀1反应的离子方程式为___________
(4)同学们取5mL该废水于一试管中,向该试管中逐滴加入NaOH溶液至溶液呈碱性,在此过程中,原废水中的离子的物质的量会发生明显变化的是___________ (填离子符号)。
 ,某学校化学兴趣小组同学设计如图方案将该酸性废水变废为宝。
,某学校化学兴趣小组同学设计如图方案将该酸性废水变废为宝。
已知:Fe(OH)2在空气中难以稳定存在,极易被氧化为Fe(OH)3
回答下列问题:
(1)粉末a的成分为
(2)试剂b为
(3)试剂b与沉淀1反应的离子方程式为
(4)同学们取5mL该废水于一试管中,向该试管中逐滴加入NaOH溶液至溶液呈碱性,在此过程中,原废水中的离子的物质的量会发生明显变化的是
您最近半年使用:0次
20-21高一下·江苏苏州·期中
6 . 由下列实验及现象不能推出相应结论的是
| 实验 | 现象 | 结论 | |
| A | 向2 mL0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSEN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集 满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 | 碘易溶于有机溶剂 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
7 . 下列实验操作及现象、结论均正确的是
实验操作及现象 | 结论 | |
A | 加热坩埚,迅速投入绿豆大小的金属钠,眼睛近距离俯视观察到钠先熔化后出现黄色火焰,生成淡黄色固体 | Na在空气燃烧生成Na2O2 |
B | 向硅酸钠水溶液中滴加盐酸,出现白色沉淀硅酸 | 非金属性:Cl>Si |
C | 将点燃的H2伸入盛满Cl2的集气瓶中,发生剧烈爆炸 | H2和Cl2剧烈反应 |
D | FeCl3溶液中加入足量铁粉,铁粉溶解,溶液由棕黄色变为浅绿色 | Fe3+具有氧化性,Fe具有还原性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-02-17更新
|
82次组卷
|
3卷引用:安徽省阜阳市红旗中学2023-2024学年高一上学期期末考试 化学试题
名校
8 . 某化学兴趣小组利用废铁屑(含少量 )制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
)制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。

请回答下列问题:
(1)“酸溶”时,搅拌的目的是_______ 。
(2)“操作Y”为_______ (填操作名称),经过“操作Y”得到了滤渣 ,则物质X可用于除去过量的稀硫酸和防止
,则物质X可用于除去过量的稀硫酸和防止 被氧化,可选择
被氧化,可选择_______ (填试剂名称),“转化2”发生反应的离子方程式为_______ 。
(3)“洗涤”时,能证明滤渣洗涤干净的操作及现象为_______ 。
(4)麦片中常添加微量还原性铁粉,用于补充入体所需的铁元素,这些铁粉在胃酸(主要成分为盐酸)的作用下发生反应变成人体容易吸收的铁元素,发生反应的化学方程式为_______ ;人体补铁时,同时服用维生素C能促进亚铁离子被吸收,说明维生素C具有_______ (填“氧化性”或“还原性”)。
 )制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
)制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
请回答下列问题:
(1)“酸溶”时,搅拌的目的是
(2)“操作Y”为
 ,则物质X可用于除去过量的稀硫酸和防止
,则物质X可用于除去过量的稀硫酸和防止 被氧化,可选择
被氧化,可选择(3)“洗涤”时,能证明滤渣洗涤干净的操作及现象为
(4)麦片中常添加微量还原性铁粉,用于补充入体所需的铁元素,这些铁粉在胃酸(主要成分为盐酸)的作用下发生反应变成人体容易吸收的铁元素,发生反应的化学方程式为
您最近半年使用:0次
2022-12-07更新
|
226次组卷
|
4卷引用:四川省成都市四校2022-2023学年高一上学期12月联考化学试题
四川省成都市四校2022-2023学年高一上学期12月联考化学试题四川省眉山市彭山区第一中学2022-2023学年高一上学期第二次模拟选科调考化学试题云南省楚雄彝族自治州2022-2023学年高一上学期期末教育学业质量监测化学试题(已下线)第13讲 铁和铁的氧化物-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)
9 . 由下列实验及现象不能推出相应结论的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向2 mL 0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: Fe>Fe2+ |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3 显碱性 |
| D | SO2通入含HCl、BaCl2的FeCl3溶液中 | 产生白色沉淀 | SO2有还原性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2018-09-05更新
|
507次组卷
|
2卷引用:2018-2019学年人教版高中化学必修一模块综合测评题(A)
名校
解题方法
10 . 某同学利用下列电池装置进行实验,探究 的氧化性和还原性。
的氧化性和还原性。
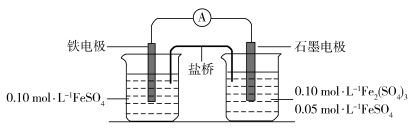
根据实验现象,下列分析不正确 的是
 的氧化性和还原性。
的氧化性和还原性。
根据实验现象,下列分析
| A.电流表显示电子由铁电极流向石墨电极,可知盐桥中的阳离子进入石墨电极溶液中 |
B.一段时间后石墨电极上未见 析出且铁电极溶液中 析出且铁电极溶液中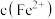 增大,可知石墨电极溶液中 增大,可知石墨电极溶液中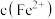 也增大 也增大 |
C.由A、B中的现象可知, 还原性小于 还原性小于 、氧化性小于 、氧化性小于 |
D.一段时间后两极溶液中的 浓度若相等,说明反应已达到平衡状态 浓度若相等,说明反应已达到平衡状态 |
您最近半年使用:0次
2022-06-03更新
|
793次组卷
|
6卷引用:北京市和平街第一中学2021-2022学年高三下学期保温化学试题
北京市和平街第一中学2021-2022学年高三下学期保温化学试题(已下线)第09讲 铁及其重要化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题(已下线)专题12 电化学的综合应用(已下线)2022年北京高考真题化学试题变式题(选择题11-14)广东省梅州市大埔县虎山中学2022-2023学年高三上学期12月月考化学试题



