14-15高二上·上海宝山·期中
名校
解题方法
1 . 将Fe粉、Cu粉、FeCl3溶液、FeCl2溶液和CuCl2溶液,混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有_______________ ;
(2)若氯化铜有剩余,则容器中还可能有_____________ ,一定有_________ ;
(3)若氯化铁有剩余,则容器中不可能有____________ ;
(4)由以上反应可知金属离子的氧化性强弱顺序为_______________ 。
(1)若铁粉有剩余,则容器中不可能有
(2)若氯化铜有剩余,则容器中还可能有
(3)若氯化铁有剩余,则容器中不可能有
(4)由以上反应可知金属离子的氧化性强弱顺序为
您最近一年使用:0次
19-20高一·全国·课时练习
2 . 已知X为Fe2O3和CuO的混合物,且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
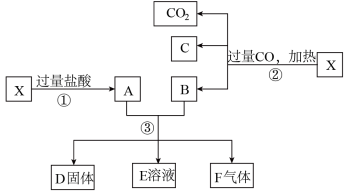
(1)写出步骤③可能发生反应的离子方程式:___ 。
(2)若溶液E中只有一种金属离子,则一定是____ ;若溶液E中含有两种金属离子,则一定是___ 。
(3)若D固体是纯净物,该固体是__ (填化学式)。

(1)写出步骤③可能发生反应的离子方程式:
(2)若溶液E中只有一种金属离子,则一定是
(3)若D固体是纯净物,该固体是
您最近一年使用:0次
名校
3 . 用过量的FeCl3溶液腐蚀铜制线路板,反应是Cu + 2FeCl3= 2FeCl2 + CuCl2 。取少量腐蚀反应完毕后的混合溶液,加入一定量的铁粉充分搅拌,发现仍有固体存在。则下列判断不正确 的是( )
| A.氧化性Fe3+ > Cu2+ | B.剩余固体中一定含Cu |
| C.有固体存在的溶液中一定无Cu2+ | D.有固体存在的溶液中一定含Fe2+ |
您最近一年使用:0次
2019-11-18更新
|
840次组卷
|
6卷引用:陕西省西安中学2020届高三上学期期中考试化学试题
名校
解题方法
4 . 为不断满足人民群众对美好生活的需要,水资源保护已经成为我国生态建设的重要领域。水处理技术的目的在于使废水经过技术处理后达到再次使用或者排放的水质要求,被广泛应用于工业、农业、环保、餐饮等各个行业,与人们的日常生活密切相关。经检测,某工厂的酸性废水中所含离子及其浓度如下表所示:
回答下列问题:
Ⅰ.
(1)该工业废水中
___________  。
。
Ⅱ.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾( )。
)。
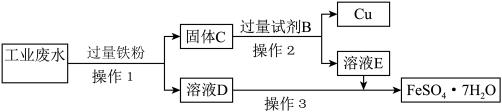
(2)在实验室完成操作1,需用到的玻璃仪器除烧杯、玻璃棒外,还有___________ 。
(3)工业废水中加入铁粉后,反应的离子方程式为 、
、___________ 、___________ 。
(4)试剂B是___________ 。
(5)操作3是蒸发浓缩、___________ 、过滤,最后用少量冷水洗涤晶体,在低温下干燥。
(6)证明溶液E中只含有 而不含
而不含 的实验方法:取少量溶液E于试管中,
的实验方法:取少量溶液E于试管中,___________ (填字母)。
a.先加氯水,再加KSCN溶液后显红色
b.先加KSCN溶液,不显红色,再加氯水后显红色
c.滴加NaOH溶液,只产生白色沉淀,且白色沉淀迅速变为灰绿色,最后呈红褐色
| 离子 |  |  |  |  |  |
浓度/( ) ) | 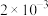 | 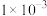 | 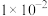 | 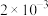 |
Ⅰ.
(1)该工业废水中

 。
。Ⅱ.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(
 )。
)。
(2)在实验室完成操作1,需用到的玻璃仪器除烧杯、玻璃棒外,还有
(3)工业废水中加入铁粉后,反应的离子方程式为
 、
、(4)试剂B是
(5)操作3是蒸发浓缩、
(6)证明溶液E中只含有
 而不含
而不含 的实验方法:取少量溶液E于试管中,
的实验方法:取少量溶液E于试管中,a.先加氯水,再加KSCN溶液后显红色
b.先加KSCN溶液,不显红色,再加氯水后显红色
c.滴加NaOH溶液,只产生白色沉淀,且白色沉淀迅速变为灰绿色,最后呈红褐色
您最近一年使用:0次
2023-04-23更新
|
257次组卷
|
2卷引用:贵州省铜仁市2022-2023学年高一上学期期末考试化学试题
名校
5 . 某化学兴趣小组利用还原铁粉处理含Fe(NO3)3、Cu(NO3)2、HNO3的废水,所加还原铁粉的质量与溶液中Fe2+的浓度变化关系如下图(忽略溶液体积变化)。下列有关结论错误的是


| A.加入铁粉质量小于56g时发生的反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O |
| B.当加入的铁粉质量超过168g后,溶液中的溶质只含有Fe(NO3)2(忽略Fe2+的水解) |
| C.原废水中三种物质的氧化性由强到弱的顺序是HNO3>Fe(NO3)3>Cu(NO3)2 |
| D.原废水中Fe(NO3)3的浓度为2mol/L,Cu(NO3)2的浓度均为1mol/L |
您最近一年使用:0次
名校
6 . 氧化性Fe3+>Cu2+,向物质的量浓度均为2mol/L的Fe2(SO4)3、CuSO4的500mL混合液中加入a mol铁粉,充分反应后,下列说法不正确的是
| A.当a≤1时,发生的反应为2Fe3++Fe=3Fe2+ |
| B.当a≥2时,发生的反应为2Fe3++2Cu2++3Fe=5Fe2++2Cu |
| C.当1≤a<2时,溶液中 n(Fe2+)=(2+a)mol |
| D.若有固体剩余,则固体中一定有铜,可能有铁 |
您最近一年使用:0次
7 . 实验室产生的酸性废液中含有Fe3+、Cu2+两种金属离子,某同学设计了如图所示方案对废液进行处理来回收金属,保护环境。
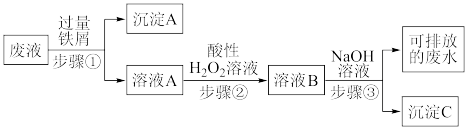
(1)沉淀A的成分是:_____ (写化学式),若步骤①中加入少量铁屑,无沉淀生成,此时发生反应的离子方程式为____ 。
(2)如何检验溶液A中的金属阳离子,简述其方法:_____ 。
(3)写出步骤②发生反应的化学方程式:_____ 。
(4)步骤③的操作名称是____ ,用到的主要玻璃仪器有烧杯、____ ,沉淀C与胶体C的本质区别是:____ 。

(1)沉淀A的成分是:
(2)如何检验溶液A中的金属阳离子,简述其方法:
(3)写出步骤②发生反应的化学方程式:
(4)步骤③的操作名称是
您最近一年使用:0次
名校
解题方法
8 . 已知氧化性Fe3+>Cu2+把铁和铜加入到氯化铁和氯化铜的混合溶液中,反应后铁有剩余则
| A.溶液中有Fe2+、Cu2+ | B.剩下的固体是Fe和Cu |
| C.溶液中有Fe3+、Fe2+ | D.剩下的固体是Fe,无Cu |
您最近一年使用:0次
2019-04-01更新
|
302次组卷
|
7卷引用:2014-2015宁夏回族自治区银川一中高一上学期期末考试化学试卷
名校
9 . 某化学兴趣小组利用还原铁粉处理含Fe(NO3)3、Cu(NO3)2、HNO3的废水,所加还原铁粉的质量与溶液中Fe2+的浓度变化关系如下图(忽略溶液体积变化)。下列有关结论错误的是( )


| A.加入铁粉质量小于56g时发生的反应为 Fe+NO3-+4H+=Fe3++NO↑+2H2O |
| B.当加入的铁粉质量超过168g后,溶液中的溶质只含有Fe(NO3)2 (忽略Fe2+的水解) |
| C.原废水中Fe(NO3)3的浓度为2mol/L,Cu(NO3)2的浓度均为1mol/L |
| D.原废水中三种物质的氧化性由强到弱的顺序是HNO3>Fe(NO3)3>Cu(NO3)2 |
您最近一年使用:0次
2018-05-09更新
|
118次组卷
|
2卷引用:【全国市级联考】贵州省贵阳市2018届高三5月适应性考试(二)理综化学试题
解题方法
10 . FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)_______ 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。完成NaClO3氧化FeCl2的离子方程式:_______
某化学研究性学习小组探究Fe3+和 之间发生的反应
之间发生的反应
(3)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为_______ 。
(4)研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
(方案一)检验溶液中含有Fe2+证明发生了氧化还原反应
(方案二)检验溶液中含有_______ 证明发生了氧化还原反应
Ⅰ.预处理:将(方案一)中获得的混合物放在如图装置中处理足够时间。

Ⅱ.检验过程
①简述证明溶液中含有Fe2+的操作方法及现象:_______ ;
②检验溶液中含有另一种离子可选用的试剂是:_______ 。
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。完成NaClO3氧化FeCl2的离子方程式:
某化学研究性学习小组探究Fe3+和
 之间发生的反应
之间发生的反应(3)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为
(4)研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
(方案一)检验溶液中含有Fe2+证明发生了氧化还原反应
(方案二)检验溶液中含有
Ⅰ.预处理:将(方案一)中获得的混合物放在如图装置中处理足够时间。

Ⅱ.检验过程
①简述证明溶液中含有Fe2+的操作方法及现象:
②检验溶液中含有另一种离子可选用的试剂是:
您最近一年使用:0次



