解题方法
1 . 根据实验目的,下列实验及现象操作、结论都正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 制备Fe(OH)3胶体 | 向沸水中逐滴加入5~6滴饱和FeCl3溶液,持续加热,生成红褐色固体 | FeCl3与水反应产生Fe(OH)3胶体 |
| B | 验证Cl2的漂白性 | 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃瓶,一段时间后有色鲜花褪色 | Cl2有漂白性 |
| C | 检验溶液中的Na+ | 用硫酸洗净后的铂丝蘸取少量溶液在酒精灯外焰上灼烧,产生黄色火焰 | 溶液中存在Na+ |
| D | 验证Fe3+的氧化性 | 在盛有2mLFeCl3的溶液中加入过量Fe粉,充分振荡后滴入几滴KSCN溶液,溶液未变红色 | Fe3+可以被Fe还原 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 元素周期表中大多数元素是金属元素。小刀日常民用,大到国防军工,都能看到金属材料的身影。其中铁元素是最常见金属材料的组成元素。
(1)铁元素的相关信息如图所示,其相对原子质量是_______ 。

(2)有关铁的性质,说法正确的是_______。(选填编号)
(3)还原Fe粉可作脱氧剂,使用后为红棕色。将一包部分变质的脱氧剂用稀盐酸浸泡,浸泡过程中粉末表面会产生大量细小的无色气泡。补全溶液中可能发生的离子反应: Fe+2H+=Fe2++H2↑;_______ ;2Fe3++Fe=3Fe2+。
(4)若上述溶液充分反应后只含有Fe2+,欲检验Fe2+,不合理的操作是_______。(选填编号)
(1)铁元素的相关信息如图所示,其相对原子质量是

(2)有关铁的性质,说法正确的是_______。(选填编号)
| A.在空气中,加热Fe(OH)2可得FeO |
| B.一定条件下,Fe能与水蒸气反应生成H2 |
| C.常温下,Fe与浓H2SO4反应能产生SO2 |
| D.实验室用FeCl3溶液与NaOH溶液反应制备Fe(OH)3胶体 |
(4)若上述溶液充分反应后只含有Fe2+,欲检验Fe2+,不合理的操作是_______。(选填编号)
| A.加入氢氧化钠溶液观察现象 |
| B.先加入足量氯水,再加入KSCN溶液 |
| C.加入少量酸性KMnO4溶液观察现象 |
| D.先加入KSCN溶液,再滴加少量氯水观察现象 |
您最近一年使用:0次
3 . 铁泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(FeSO4·7H2O)或柠檬酸铁铵。

(1)过程I
① Fe2O3与硫酸反应的离子方程式为_______ 。
② 分离出杂质的操作是_______ 。
(2)制备柠檬酸铁铵
① 补全过程II中发生反应的离子方程式:_______ 。
_______+1 H+ +1 H2O2 = 1 Fe3++1 _______。
② 过程III中,加入氨水后,可观察到的现象为_______ 。
(3)制备FeSO4·7H2O
过程V中,用离子方程式说明加入铁屑的主要目的是_______ 。

(1)过程I
① Fe2O3与硫酸反应的离子方程式为
② 分离出杂质的操作是
(2)制备柠檬酸铁铵
① 补全过程II中发生反应的离子方程式:
_______+1 H+ +1 H2O2 = 1 Fe3++1 _______。
② 过程III中,加入氨水后,可观察到的现象为
(3)制备FeSO4·7H2O
过程V中,用离子方程式说明加入铁屑的主要目的是
您最近一年使用:0次
4 . 氯气是一种重要的化工原料,在生产和生活中的应用十分广泛,可用于制漂白剂等。
Ⅰ.制新型灭菌消毒剂ClO2.在通常状况下,ClO2能溶于水,在水中的杀菌、消毒能力比Cl2强,且ClO2、Cl2在杀菌、消毒时均被还原为Cl-;浓的ClO2受热时易爆炸。
(1)制备ClO2反应为Cl2+2NaClO2=2NaCl+2ClO2,实验装置如下图所示:
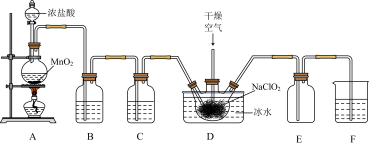
①装置A中发生反应的化学方程式为___________ ,装置B中盛放的试剂为___________ 。
②装置D中将三颈烧瓶置于冰水浴中并向其中通入干燥空气的目的是___________ 。
(2)等物质的量的ClO2和Cl2相比,ClO2的杀菌、消毒能力强于Cl2的原因是___________ 。
Ⅱ.制优良的饮用水消毒剂Na2FeO4.Na2FeO4具有很强的氧化性,能有效地杀灭水中的病菌和病毒,同时自身被还原成新生态的Fe(OH)3。
(3)制备方法如下:Fe(NO3)3+NaOH+Cl2—Na2FeO4+NaNO3+NaCl+H2O(未配平)。
①Na2FeO4中铁元素的化合价是___________ ,Na2FeO4属于___________ (填序号)。
A.酸 B.碱 C.盐 D.氧化物
②Na2FeO4作饮用水消毒剂的同时也能够起到净水作用的原因是___________ 。
Ⅰ.制新型灭菌消毒剂ClO2.在通常状况下,ClO2能溶于水,在水中的杀菌、消毒能力比Cl2强,且ClO2、Cl2在杀菌、消毒时均被还原为Cl-;浓的ClO2受热时易爆炸。
(1)制备ClO2反应为Cl2+2NaClO2=2NaCl+2ClO2,实验装置如下图所示:

①装置A中发生反应的化学方程式为
②装置D中将三颈烧瓶置于冰水浴中并向其中通入干燥空气的目的是
(2)等物质的量的ClO2和Cl2相比,ClO2的杀菌、消毒能力强于Cl2的原因是
Ⅱ.制优良的饮用水消毒剂Na2FeO4.Na2FeO4具有很强的氧化性,能有效地杀灭水中的病菌和病毒,同时自身被还原成新生态的Fe(OH)3。
(3)制备方法如下:Fe(NO3)3+NaOH+Cl2—Na2FeO4+NaNO3+NaCl+H2O(未配平)。
①Na2FeO4中铁元素的化合价是
A.酸 B.碱 C.盐 D.氧化物
②Na2FeO4作饮用水消毒剂的同时也能够起到净水作用的原因是
您最近一年使用:0次
名校
5 . 一种以钛铁矿( ,含
,含 、CaO、
、CaO、 等杂质)为主要原料制备钛白粉(
等杂质)为主要原料制备钛白粉( )的工艺流程如图所示。
)的工艺流程如图所示。
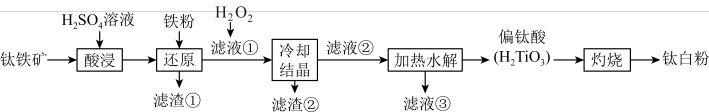
已知:
① 不溶于水和稀酸;
不溶于水和稀酸;
②“酸浸”后钛元素主要以 形式存在;
形式存在;
③ 在pH=1.8时生成沉淀,pH=4.1时沉淀完全。
在pH=1.8时生成沉淀,pH=4.1时沉淀完全。
回答下列问题:
(1)“酸浸”时,常将钛铁矿粉碎,并进行搅拌,其目的是_____ 。
(2)“酸浸”时, 发生反应的化学方程式为
发生反应的化学方程式为_____ 。
(3)滤渣①的主要成分是_____ 、_____ (填化学式)和 。
。
(4)流程中加入铁粉的目的是还原体系中的 ,反应的离子方程式为
,反应的离子方程式为_____ 。为探究最佳反应条件,某化学兴趣小组在保持反应时间相同的情况下进行探究得到结果如下图所示。
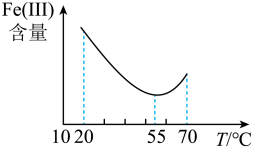
保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度变化如图所示。由图可知,还原体系中Fe(Ⅲ)的最佳反应温度为_____ ℃。
(5)经处理后,流程中可循环利用的物质除Fe外,还有_____ (填化学式)。
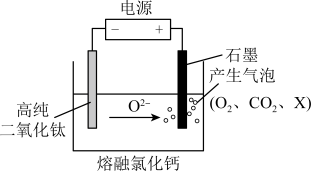
(6)如图为EFC剑桥法用固体二氧化钛( )生产海绵钛的装置示意图,其原理是在较低的阴极电位下,
)生产海绵钛的装置示意图,其原理是在较低的阴极电位下, (阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为__________ ,产生的气体中X的化学式为_____ 。
 ,含
,含 、CaO、
、CaO、 等杂质)为主要原料制备钛白粉(
等杂质)为主要原料制备钛白粉( )的工艺流程如图所示。
)的工艺流程如图所示。
已知:
①
 不溶于水和稀酸;
不溶于水和稀酸;②“酸浸”后钛元素主要以
 形式存在;
形式存在;③
 在pH=1.8时生成沉淀,pH=4.1时沉淀完全。
在pH=1.8时生成沉淀,pH=4.1时沉淀完全。回答下列问题:
(1)“酸浸”时,常将钛铁矿粉碎,并进行搅拌,其目的是
(2)“酸浸”时,
 发生反应的化学方程式为
发生反应的化学方程式为(3)滤渣①的主要成分是
 。
。(4)流程中加入铁粉的目的是还原体系中的
 ,反应的离子方程式为
,反应的离子方程式为
保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度变化如图所示。由图可知,还原体系中Fe(Ⅲ)的最佳反应温度为
(5)经处理后,流程中可循环利用的物质除Fe外,还有
(6)如图为EFC剑桥法用固体二氧化钛(
 )生产海绵钛的装置示意图,其原理是在较低的阴极电位下,
)生产海绵钛的装置示意图,其原理是在较低的阴极电位下, (阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
您最近一年使用:0次
6 . 聚合硫酸铁又称聚铁,化学式[Fe2(OH)n(SO4)3-0.5n]n,广泛用于污水处理,实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、 SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
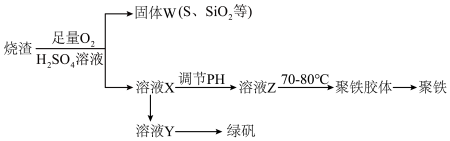
(1)验证固体W焙烧后产生的气体含有SO2的方法是_____________ 。
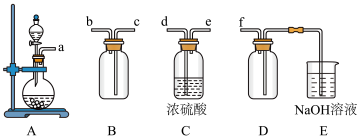
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口,顺序为a→_____ →_____ →_____ →_____ →f。装置D的作用是_________ ,装置E中NaOH溶液的作用是________________ 。
(3)制备绿矾时,向溶液X中加入过量_________ ,充分反应后,经_________ 操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________ 。
若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____________________ 。

(1)验证固体W焙烧后产生的气体含有SO2的方法是
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口,顺序为a→

(3)制备绿矾时,向溶液X中加入过量
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为
若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏
您最近一年使用:0次
2019-01-30更新
|
1021次组卷
|
5卷引用:2010-2011学年浙江省瑞安中学高二下学期期中考试化学试卷
(已下线)2010-2011学年浙江省瑞安中学高二下学期期中考试化学试卷2010年普通高等学校招生全国统一考试理综化学部分(山东卷)2010年高考化学试题分项专题十二 非金属元素及其化合物2010年高考化学试题分项专题十五 化学实验(已下线)2013届福建省清流一中高三第三阶段考试化学试卷



