名校
1 . 一种以钛铁矿( ,含
,含 、CaO、
、CaO、 等杂质)为主要原料制备钛白粉(
等杂质)为主要原料制备钛白粉( )的工艺流程如图所示。
)的工艺流程如图所示。
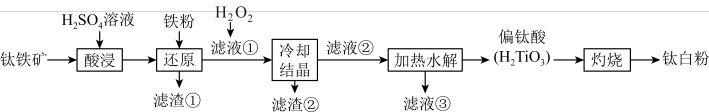
已知:
① 不溶于水和稀酸;
不溶于水和稀酸;
②“酸浸”后钛元素主要以 形式存在;
形式存在;
③ 在pH=1.8时生成沉淀,pH=4.1时沉淀完全。
在pH=1.8时生成沉淀,pH=4.1时沉淀完全。
回答下列问题:
(1)“酸浸”时,常将钛铁矿粉碎,并进行搅拌,其目的是_____ 。
(2)“酸浸”时, 发生反应的化学方程式为
发生反应的化学方程式为_____ 。
(3)滤渣①的主要成分是_____ 、_____ (填化学式)和 。
。
(4)流程中加入铁粉的目的是还原体系中的 ,反应的离子方程式为
,反应的离子方程式为_____ 。为探究最佳反应条件,某化学兴趣小组在保持反应时间相同的情况下进行探究得到结果如下图所示。
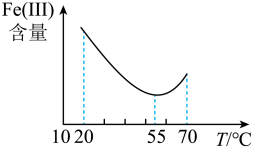
保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度变化如图所示。由图可知,还原体系中Fe(Ⅲ)的最佳反应温度为_____ ℃。
(5)经处理后,流程中可循环利用的物质除Fe外,还有_____ (填化学式)。
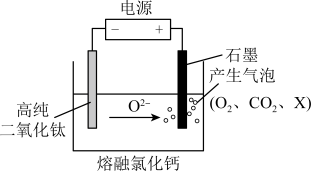
(6)如图为EFC剑桥法用固体二氧化钛( )生产海绵钛的装置示意图,其原理是在较低的阴极电位下,
)生产海绵钛的装置示意图,其原理是在较低的阴极电位下, (阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为__________ ,产生的气体中X的化学式为_____ 。
 ,含
,含 、CaO、
、CaO、 等杂质)为主要原料制备钛白粉(
等杂质)为主要原料制备钛白粉( )的工艺流程如图所示。
)的工艺流程如图所示。
已知:
①
 不溶于水和稀酸;
不溶于水和稀酸;②“酸浸”后钛元素主要以
 形式存在;
形式存在;③
 在pH=1.8时生成沉淀,pH=4.1时沉淀完全。
在pH=1.8时生成沉淀,pH=4.1时沉淀完全。回答下列问题:
(1)“酸浸”时,常将钛铁矿粉碎,并进行搅拌,其目的是
(2)“酸浸”时,
 发生反应的化学方程式为
发生反应的化学方程式为(3)滤渣①的主要成分是
 。
。(4)流程中加入铁粉的目的是还原体系中的
 ,反应的离子方程式为
,反应的离子方程式为
保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度变化如图所示。由图可知,还原体系中Fe(Ⅲ)的最佳反应温度为
(5)经处理后,流程中可循环利用的物质除Fe外,还有
(6)如图为EFC剑桥法用固体二氧化钛(
 )生产海绵钛的装置示意图,其原理是在较低的阴极电位下,
)生产海绵钛的装置示意图,其原理是在较低的阴极电位下, (阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为
您最近一年使用:0次
名校
解题方法
2 . 黄铁矿烧渣(主要成分为Fe2O3、FeO、及少量FeS、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)(主要成分为Fe2O3不考虑其他杂质),并以铁红为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺:
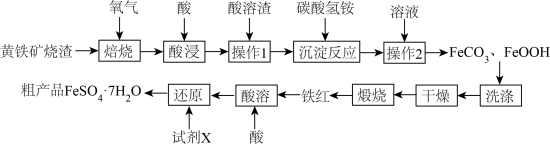
(1)焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是_______ (任答两点)。

(2)“酸浸”时温度比较高,最适合的酸是_______ ,“酸溶渣”的成分是_______ 。
(3)“沉淀反应”中,生成FeCO3的离子方程式是_______ 。
(4)检验FeCO3是否洗涤干净的操作方法_______ 。
(5)从过滤后的滤液中得到产品,应进行的操作是_______ 、_______ 、过滤、洗涤、干燥。
(6)FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量:
步骤I:取20片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液。
步骤Ⅱ:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0200 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应,且 )。
)。
步骤Ⅲ:重复“步骤II”2-3次,平均消耗KMnO4溶液10.00mL。
①步骤I中配制溶液时需要的玻璃仪器除烧杯、量筒,玻璃棒外,还需要_______ 、_______ 。
②该补血剂中亚铁离子的含量为_______ mg/片。

(1)焙烧的过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是

(2)“酸浸”时温度比较高,最适合的酸是
(3)“沉淀反应”中,生成FeCO3的离子方程式是
(4)检验FeCO3是否洗涤干净的操作方法
(5)从过滤后的滤液中得到产品,应进行的操作是
(6)FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量:
步骤I:取20片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液。
步骤Ⅱ:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0200 mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应,且
 )。
)。步骤Ⅲ:重复“步骤II”2-3次,平均消耗KMnO4溶液10.00mL。
①步骤I中配制溶液时需要的玻璃仪器除烧杯、量筒,玻璃棒外,还需要
②该补血剂中亚铁离子的含量为
您最近一年使用:0次
2022-11-13更新
|
217次组卷
|
2卷引用:浙江省杭州地区(含周边)重点中学2022-2023学年高二上学期期中考试化学试题
20-21高一下·江苏苏州·期中
名校
解题方法
3 . 铁及其化合物在日常生活中应用广泛,请回答下列问题:
(1) Fe(NO3)3·9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂,工业上用细铁屑与稀硝随反应制备,主要流程如下:

①写出铁屑与稀硝酸反应的化学方程式___________ 。反应时温度控制在40 -50℃,不宜过高的原因是___________ 。
②制备过程中需控制加入铁屑的量,原因是___________ (用离子方程式回答)。
③制得的Fe(NO3)3·9H2O用20%HNO3洗涤,其原因是___________ 。
(2)上述工业生产的尾气中含有氮氧化物NOx,(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁,工业上常用Na2CO3溶液吸收处理NOx。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO3+CO2 (I)
2NO2+Na2CO3=NaNO2+NaNO3+CO2 (II)
①将1 mol NOx通入Na2CO3溶液中被完全吸收时,溶液中生成的 、
、 两种离子的物质的量随x变化关系如下图所示,则图中线段a表示
两种离子的物质的量随x变化关系如下图所示,则图中线段a表示___________ (填离子符号)随x值变化的关系。

②为了检测吸收液中NaNO2含量,某兴趣小组取100 mL该吸收液,用0.0050 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液的体积为16.00 mL。
已知: 被氧化成
被氧化成 ,写出离子方程式
,写出离子方程式___________ ,则吸收液中NaNO2的物质的量浓度为___________ 。
(1) Fe(NO3)3·9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂,工业上用细铁屑与稀硝随反应制备,主要流程如下:

①写出铁屑与稀硝酸反应的化学方程式
②制备过程中需控制加入铁屑的量,原因是
③制得的Fe(NO3)3·9H2O用20%HNO3洗涤,其原因是
(2)上述工业生产的尾气中含有氮氧化物NOx,(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁,工业上常用Na2CO3溶液吸收处理NOx。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO3+CO2 (I)
2NO2+Na2CO3=NaNO2+NaNO3+CO2 (II)
①将1 mol NOx通入Na2CO3溶液中被完全吸收时,溶液中生成的
 、
、 两种离子的物质的量随x变化关系如下图所示,则图中线段a表示
两种离子的物质的量随x变化关系如下图所示,则图中线段a表示
②为了检测吸收液中NaNO2含量,某兴趣小组取100 mL该吸收液,用0.0050 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液的体积为16.00 mL。
已知:
 被氧化成
被氧化成 ,写出离子方程式
,写出离子方程式
您最近一年使用:0次
名校
解题方法
4 . 绿矾晶体( )是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为
)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为 及少量
及少量 ),制备绿矾过程如下:
),制备绿矾过程如下:

试回答:
(1)操作Ⅰ为___________ (填写操作名称)。
(2)试剂Y与溶液X反应的离子方程式为___________ 、___________
(3)操作Ⅲ的顺序依次为:___________ 。
(4)某同学用酸性 溶液测定绿矾产品中
溶液测定绿矾产品中 含量:
含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积的平均值为20.00mL。
溶液的体积的平均值为20.00mL。
配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需___________
 )是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为
)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为 及少量
及少量 ),制备绿矾过程如下:
),制备绿矾过程如下:
试回答:
(1)操作Ⅰ为
(2)试剂Y与溶液X反应的离子方程式为
(3)操作Ⅲ的顺序依次为:
(4)某同学用酸性
 溶液测定绿矾产品中
溶液测定绿矾产品中 含量:
含量:a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积的平均值为20.00mL。
溶液的体积的平均值为20.00mL。配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需
您最近一年使用:0次
解题方法
5 . 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O(Mr=288g/mol)}几乎不溶于乙醇﹐易被氧化,以赤铁矿渣(主要成分Fe2O3,含少量Al2O3,SiO2杂质)和乳酸[CH3CH(OH)COOH]为原料制取乳酸亚铁晶体的工艺如图所示:

已知:
碳酸亚铁和氢氧化亚铁颜色不同;乳酸亚铁的溶解度随温度升高而明显增大。
回答下列问题:
(1)“滤渣”的主要成分是___ (填化学式,下同)。“固体A”是____ 。
(2)常温下,调pH=3.5~4.1的目的是____ 。
(3)“转化”具体过程为在45~50℃和pH=2.5~3.0条件下反应40 min左右,指出pH=2.5~3.0的原因___ 。“操作2”为隔绝空气蒸发浓缩,趁热过滤、冷却结晶,过滤﹐乙醇洗涤﹐干燥,密封储存。隔绝空气的目的是_____ 。
(4)写出“沉铁”过程中生成FeCO3的离子方程式:______ 。
(5)1 t赤铁矿渣中主要成分含量为40%,实际得到乳酸亚铁晶体的质量为0.288 t,则生产的产率为______ 。

已知:
金属氢氧化物 | 溶度积 | 开始沉淀时的pH | 沉淀完全时的pH |
Al(OH)3 | 2×10-32 | 4.1 | 5.4 |
Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
回答下列问题:
(1)“滤渣”的主要成分是
(2)常温下,调pH=3.5~4.1的目的是
(3)“转化”具体过程为在45~50℃和pH=2.5~3.0条件下反应40 min左右,指出pH=2.5~3.0的原因
(4)写出“沉铁”过程中生成FeCO3的离子方程式:
(5)1 t赤铁矿渣中主要成分含量为40%,实际得到乳酸亚铁晶体的质量为0.288 t,则生产的产率为
您最近一年使用:0次
6 . 聚合硫酸铁又称聚铁,化学式[Fe2(OH)n(SO4)3-0.5n]n,广泛用于污水处理,实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、 SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
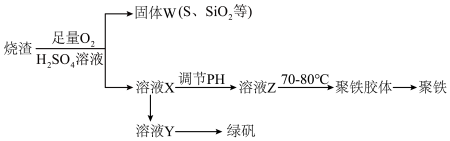
(1)验证固体W焙烧后产生的气体含有SO2的方法是_____________ 。
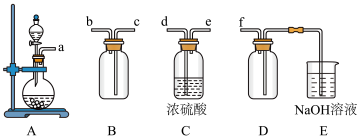
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口,顺序为a→_____ →_____ →_____ →_____ →f。装置D的作用是_________ ,装置E中NaOH溶液的作用是________________ 。
(3)制备绿矾时,向溶液X中加入过量_________ ,充分反应后,经_________ 操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________ 。
若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____________________ 。

(1)验证固体W焙烧后产生的气体含有SO2的方法是
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口,顺序为a→

(3)制备绿矾时,向溶液X中加入过量
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为
若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏
您最近一年使用:0次
2019-01-30更新
|
1021次组卷
|
5卷引用:2010-2011学年浙江省瑞安中学高二下学期期中考试化学试卷
(已下线)2010-2011学年浙江省瑞安中学高二下学期期中考试化学试卷2010年普通高等学校招生全国统一考试理综化学部分(山东卷)2010年高考化学试题分项专题十二 非金属元素及其化合物2010年高考化学试题分项专题十五 化学实验(已下线)2013届福建省清流一中高三第三阶段考试化学试卷
7 . 下列关于各图的叙述正确的是
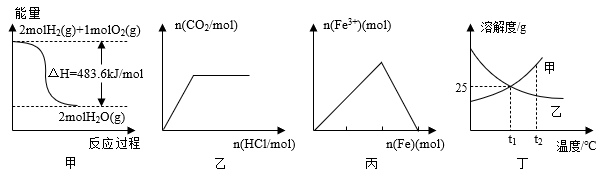

| A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 |
| B.乙表示向碳酸钠溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸的物质的量的关系 |
| C.丙表示在稀硝酸溶液中加入铁粉,溶液中Fe3+的变化曲线 |
| D.丁表示t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 |
您最近一年使用:0次
2016-12-09更新
|
191次组卷
|
3卷引用:2016届江苏省泰州中学高三上学期期中测试化学试卷



