名校
解题方法
1 . 硫化铋在光电、催化及储能方面有着广泛应用,还可用作新型锂离子电池的电极材料。以浮选过的辉铋矿(主要成分是Bi2S3,还含少量Fe2O3、SiO2等杂质)为原料制备高纯 Bi2S3的工艺流程如下:

已知:铋单质不溶于盐酸,可溶于硝酸,BiCl3极易水解生成BiOCl沉淀。
回答下列问题:
(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:___________ 。
(2)“浸出”时加入盐酸,既可提高铋的浸出率,又可_____ ;滤渣1的主要成分是S和______ 。
(3) “还原”过程中发生置换反应的离子是___________ ,过量的铁粉可用___________ 除去。检验过滤后的铋粉是否洗净的方法是___________ 。
(4)如把铋粉空气氧化后“酸溶”改为直接用浓硝酸氧化铋粉,不足之处是___________ 。
(5)用Bi2S3/石墨烯复合材料、高纯锂作电极,LiPF6+EC/EMC作电解液制成的电池如图所示。放电时电池的总反应为:Bi2S3+6Li=3Li2S+2Bi,电极材料中石墨烯的作用是___________ 。放电时负极的电极反应为___________ 充电时阳极的电极反应为___________ 。


已知:铋单质不溶于盐酸,可溶于硝酸,BiCl3极易水解生成BiOCl沉淀。
回答下列问题:
(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:
(2)“浸出”时加入盐酸,既可提高铋的浸出率,又可
(3) “还原”过程中发生置换反应的离子是
(4)如把铋粉空气氧化后“酸溶”改为直接用浓硝酸氧化铋粉,不足之处是
(5)用Bi2S3/石墨烯复合材料、高纯锂作电极,LiPF6+EC/EMC作电解液制成的电池如图所示。放电时电池的总反应为:Bi2S3+6Li=3Li2S+2Bi,电极材料中石墨烯的作用是

您最近一年使用:0次
2021-01-16更新
|
891次组卷
|
3卷引用:四川省绵阳市2021届高三第二次诊断性测试理综化学试题
四川省绵阳市2021届高三第二次诊断性测试理综化学试题 四川省眉山市彭山区第一中学2023-2024学年高三上学期开学考试理综化学试题(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)
解题方法
2 . 粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
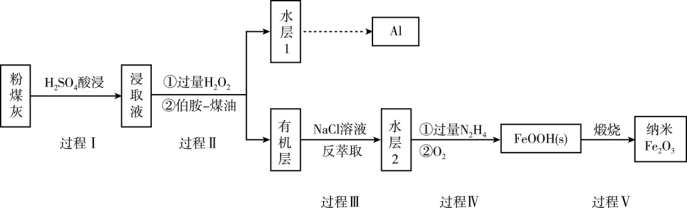
已知:
i)伯胺R-NH2能与Fe3+反应;3R-NH2+Fe3++SO42-+H2O Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl- [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_________ 。
(2)写出过程II加入过量H2O2发生的离子方程式_________ 。加入伯胺-煤油对浸取液进行分离,该操作的名称是_________ 。
(3)从化学平衡角度解释过程III利用NaCl溶液进行反萃取的原理________ 。
(4)过程IV中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+.4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_________ 。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。
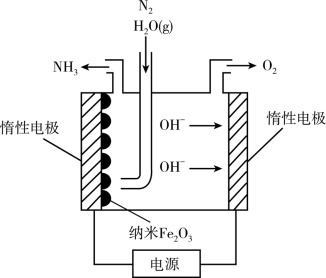
已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:该电解池第二步:2Fe+N2+3H2O=Fe2O3+2NH3。则该电解池第一步发生反应的方程式为_________ 。纳米Fe2O3在电解过程中所起的作用是_______ 。

已知:
i)伯胺R-NH2能与Fe3+反应;3R-NH2+Fe3++SO42-+H2O
 Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-
 [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是
(2)写出过程II加入过量H2O2发生的离子方程式
(3)从化学平衡角度解释过程III利用NaCl溶液进行反萃取的原理
(4)过程IV中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+.4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。

已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:该电解池第二步:2Fe+N2+3H2O=Fe2O3+2NH3。则该电解池第一步发生反应的方程式为
您最近一年使用:0次
2019高三·浙江·专题练习
名校
3 . 取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式为________________ ,反应后得到的溶液呈________ 色。用此溶液分别做如下实验:
(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为____________________________________ ,此反应属于________________ 。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈________ 色,即制得Fe(OH)3胶体。
(3)取另一只小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到__________ 烧杯中的液体产生丁达尔效应,这个实验可以用来区别________________________ 。
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化。
a.先出现红褐色沉淀,原因是__________________________________________ 。
b.随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式:________________ 。
c.最后溶液颜色加深,原因是_________________________ (用离子方程式表示)。
d.用稀盐酸代替稀HI溶液,能出现上述哪些相同的变化现象?________ (填序号)。
(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈
(3)取另一只小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化。
a.先出现红褐色沉淀,原因是
b.随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式:
c.最后溶液颜色加深,原因是
d.用稀盐酸代替稀HI溶液,能出现上述哪些相同的变化现象?
您最近一年使用:0次
名校
4 . 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究。完成下列空格。
①提出假设:
假设1:只存在Fe2O3;假设2:_________ ;假设3:既存在Fe2O3也存在Cu2O。
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出假设____ 不成立,写出产生上述气体的化学方程式___________________ 。
步骤二:取少量步骤一溶液置于试管中滴加_______ ,振荡,若________ ,则说明假设3成立。
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设_______ 不成立。
方案三:
同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数。
讨论分析:该实验方案________ (填“能”或“不能”)测出矿物中Fe2O3的质量分数。不改变装置和药品,通过计算得出矿物中Fe2O3的质量分数,你还可以通过测定_______ 。若测得m1为3.04g,m3=m2+1.76g,则原样品中Fe2O3的质量分数为_____ (结果保留四位有效数字)。
①提出假设:
假设1:只存在Fe2O3;假设2:
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出假设
步骤二:取少量步骤一溶液置于试管中滴加
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设
方案三:

同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数。
讨论分析:该实验方案
您最近一年使用:0次
2017-03-11更新
|
696次组卷
|
2卷引用:四川省泸县第四中学2020届高三上学期期末考试理综化学试题
名校
解题方法
5 . 三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是______________________ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________ 。简述你的理由_____________ .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为_________ ,写出其中发生的氧化还原反应的离子方程式____________________________ 。探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg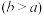 ,则混合物中Cu2O的质量分数为
,则混合物中Cu2O的质量分数为___________ 。
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg
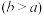 ,则混合物中Cu2O的质量分数为
,则混合物中Cu2O的质量分数为
您最近一年使用:0次
2016-12-09更新
|
321次组卷
|
3卷引用:2016届四川省宜宾三中高三上学期第一次月考化学试卷1
2010·四川成都·一模
解题方法
6 . 饱和盐溶液W的电解产物发生下列系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其它产物已略去),其中A、B、C、D、E在常温下均为高中化学中常见气态物质,X和K是中学常见的金属单质,氧化物Y是一种比较好的耐火材料。



回答下列问题:


(1)W的名称是_______________ ,G的俗名是________________ 。
(2)A分子的空间构型是____________________ ,键角是_______ 。
(3)反应(3)的化学方程式是______________ 。反应(4)的化学方程式是__________ 。
(4)饱和盐溶液W电解的离子方程式是________________________ 。
(5)已知C的燃烧热为285.8kJ/mol。试写出C完全燃烧生成液态物质的热化学方程式__________________________ 。




回答下列问题:



(1)W的名称是
(2)A分子的空间构型是
(3)反应(3)的化学方程式是
(4)饱和盐溶液W电解的离子方程式是
(5)已知C的燃烧热为285.8kJ/mol。试写出C完全燃烧生成液态物质的热化学方程式
您最近一年使用:0次
2010·四川成都·一模
解题方法
7 . 已知D、M、H是常见的非金属单质,其中M是无色气体,H是有色气体,J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1molH同时消耗4molB和1molC,K只知含有CO或CO2中的一种或两种。它们关系如图:

(1)写出下列物质的化学式: A______________ D_______________
(2)写出下列反应的化学方程式:
②_________________________________________
⑤___________________________________
(3)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用______ 方法(填序号)
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可用铝热法,若反应中1molA参加反应,转移电子的物质的量为______________________
(4)用C、J作电极,与硫酸构成如图所示电池,正极的电极反应为______________ ,当反应转移1mol电子时,负极质量增加_________ g。


(1)写出下列物质的化学式: A
(2)写出下列反应的化学方程式:
②
⑤
(3)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可用铝热法,若反应中1molA参加反应,转移电子的物质的量为
(4)用C、J作电极,与硫酸构成如图所示电池,正极的电极反应为

您最近一年使用:0次



