名校
1 . 制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol•L-1硫酸铝酸性溶液,经检验,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5(温室下,0.1 mol•L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_______ 。
(2)往溶液中加入H2O2的作用是_______ (用离子方程式表示)。
(3)加入的X试剂(填选项编号)是_______ 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是_______ 。
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为
(2)往溶液中加入H2O2的作用是
(3)加入的X试剂(填选项编号)是
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
您最近一年使用:0次
名校
2 . 某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式:___________ 。
(2)物质②为___________ 。
(3)请写出FeCl3溶液与铁粉反应的化学方程式:___________ 。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为___________ ,此过程中发生的氧化还原反应为___________ (用化学方程式表达)。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得胶体,它与FeCl3溶液、Fe(OH)3浊液的本质区别是___________ 。

(1)请写出Fe2O3与①反应的离子方程式:
(2)物质②为
(3)请写出FeCl3溶液与铁粉反应的化学方程式:
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得胶体,它与FeCl3溶液、Fe(OH)3浊液的本质区别是
您最近一年使用:0次
解题方法
3 . 某学生小组为认识铁及其化合物的性质.分散系的性质做了如下一组综合实验,根据实验流程回答相关问题。

(1)请写出Fe2O3与①反应的离子方程式:_______________________________________ 。
(2)实验室中,检验溶液中存在Fe3+的试剂是__________________ 。
(3)请写出FeCl3与铁粉反应的离子方程式:______________________ 。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________________________ ,此过程中发生的氧化还原反应为(用化学方程式表达)________________________________________________________________________ 。

(1)请写出Fe2O3与①反应的离子方程式:
(2)实验室中,检验溶液中存在Fe3+的试剂是
(3)请写出FeCl3与铁粉反应的离子方程式:
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为
您最近一年使用:0次
解题方法
4 . 某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式___________ 。
(2)请写出FeCl3与铁粉反应的离子方程式___________ 。
(3)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为___________ ,此过程中发生的氧化还原反应为(用化学方程式表达)___________ 。
(4)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③是___________ ,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_____________ 。

(1)请写出Fe2O3与①反应的离子方程式
(2)请写出FeCl3与铁粉反应的离子方程式
(3)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为
(4)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③是
您最近一年使用:0次
解题方法
5 . 铁在一定条件下的反应如图所示。请回答下列问题:
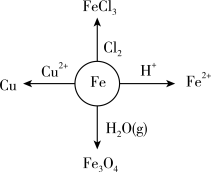
(1)晋代的《抱朴子》中有记载“以曾青涂铁,铁赤色如铜”,成为现代湿法治金的先驱。曾青就是胆矾,即五水硫酸铜。将铁放在胆矾溶液(古人称为胆水)中,可以得到金属铜,请写出该反应的化学方程式:____________ 。
(2)工业上,向500~600℃的铁屑中通入 生产
生产 ,每生产1 kg
,每生产1 kg ,消耗
,消耗 的物质的量为
的物质的量为_____ (计算结果保留2位小数)。
(3)实现Fe转化为 ,可选用
,可选用______ (填化学式)溶液。
(4)高温下,Fe粉与水蒸气反应的化学方程式为_______________ 。
(5)请写出 溶于稀盐酸的离子方程式:
溶于稀盐酸的离子方程式:_____________ 。

(1)晋代的《抱朴子》中有记载“以曾青涂铁,铁赤色如铜”,成为现代湿法治金的先驱。曾青就是胆矾,即五水硫酸铜。将铁放在胆矾溶液(古人称为胆水)中,可以得到金属铜,请写出该反应的化学方程式:
(2)工业上,向500~600℃的铁屑中通入
 生产
生产 ,每生产1 kg
,每生产1 kg ,消耗
,消耗 的物质的量为
的物质的量为(3)实现Fe转化为
 ,可选用
,可选用(4)高温下,Fe粉与水蒸气反应的化学方程式为
(5)请写出
 溶于稀盐酸的离子方程式:
溶于稀盐酸的离子方程式:
您最近一年使用:0次
2020-09-15更新
|
288次组卷
|
2卷引用:鲁科版(2019)高一必修第一册第三章第1节 铁的多样性 课时2 铁及其化合物之间的转化关系
名校
解题方法
6 . 铁与空气接触时表面会形成氧化物,如一块低碳钢可以被三种氧化物膜所覆盖:与金属接触的一侧是FeO,与空气接触的一侧是 ,而中间则是
,而中间则是 。
。
(1)中国古代“四大发明”之一的“司南”,其主要成分是上述物质中的__________ 。
(2) 的一种用途是
的一种用途是____________ 。
(3)FeO可作化妆品中的色素,它还能进行一系列转化: 。
。
①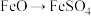 时应加入的试剂是
时应加入的试剂是____________ 。
② 是某补铁药物的主要成分,欲验证该药物超过保质期后已变质,可进行的操作是:除去药物表面包装的糖衣后将药物粉碎、加水溶解静置、
是某补铁药物的主要成分,欲验证该药物超过保质期后已变质,可进行的操作是:除去药物表面包装的糖衣后将药物粉碎、加水溶解静置、__________________ 。
③ 的实验现象是
的实验现象是___________________________ ,反应的化学方程式是__________________________________ 。
 ,而中间则是
,而中间则是 。
。(1)中国古代“四大发明”之一的“司南”,其主要成分是上述物质中的
(2)
 的一种用途是
的一种用途是(3)FeO可作化妆品中的色素,它还能进行一系列转化:
 。
。①
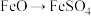 时应加入的试剂是
时应加入的试剂是②
 是某补铁药物的主要成分,欲验证该药物超过保质期后已变质,可进行的操作是:除去药物表面包装的糖衣后将药物粉碎、加水溶解静置、
是某补铁药物的主要成分,欲验证该药物超过保质期后已变质,可进行的操作是:除去药物表面包装的糖衣后将药物粉碎、加水溶解静置、③
 的实验现象是
的实验现象是
您最近一年使用:0次
解题方法
7 . 以菱铁矿(主要成分是碳酸亚铁,化学式: FeCO3)为原料制取铁的流程如图:

(1)“氧化”和“沉淀”是将“浸取”过程中产生的 Fe2+转化为Fe(OH)3沉淀, 则操作①的名称为______ (填“蒸发”或“过滤”),所用到主要玻璃仪器有_____ 。
(2)写出“沉淀” 过程中发生反应的离子方程式:__________ 。

(1)“氧化”和“沉淀”是将“浸取”过程中产生的 Fe2+转化为Fe(OH)3沉淀, 则操作①的名称为
(2)写出“沉淀” 过程中发生反应的离子方程式:
您最近一年使用:0次
2014·上海奉贤·二模
8 . 铁是人体中必需微量元素中含量最多,体内缺失会引起贫血。含FeO42-离子的盐具有强氧化性,能杀菌消毒,如高铁酸钾是一种新型、高效的消毒剂及绿色净水剂。铁及其化合物之间的相互转化可用下式表示: ,请回答下列有关问题:
,请回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是___________ (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+→Cu2++5Fe2++2S,
则下列说法正确的是_________ (选填序号);
a.反应中,所有铁元素均被还原
b.从物质的组成来看,黄铜矿属于复盐
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol 电子时,有46 g CuFeS2参加反应
(3)下列是工业制取高铁酸钾的一种方法,请在方框内填上合适的微粒符号并配平该离子方程式:
_______ Fe3+ +______ _________ +______ Cl2→_____ FeO42- + _____ Cl- +___ _____
 ,请回答下列有关问题:
,请回答下列有关问题:(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+→Cu2++5Fe2++2S,
则下列说法正确的是
a.反应中,所有铁元素均被还原
b.从物质的组成来看,黄铜矿属于复盐
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol 电子时,有46 g CuFeS2参加反应
(3)下列是工业制取高铁酸钾的一种方法,请在方框内填上合适的微粒符号并配平该离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________ ,证明Fe3+存在的现象是________ 。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________ 。
(3)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________ 。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(4)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式④____________ 。
(5)写出向⑤的混合液中通入⑥的离子方程式:______________________ 。
(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:
(3)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(4)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式④
(5)写出向⑤的混合液中通入⑥的离子方程式:
您最近一年使用:0次
名校
解题方法
10 . 铁是应用泛的金属之一,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物 的化学式。实验中称取0.54g的
的化学式。实验中称取0.54g的 样品,溶解后先进行阳离子交换预处理,再通过含有饱和
样品,溶解后先进行阳离子交换预处理,再通过含有饱和 的阴离子交换柱,使
的阴离子交换柱,使 和
和 发生交换。交换完成后,流出溶液的
发生交换。交换完成后,流出溶液的 用
用 的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出
的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出 中x的值为
中x的值为_________ (取整数)。
(2)在实验室中,FeCl2可用铁粉和_________ 反应制备,FeCl3可用铁粉和_________ 反应制备。现有一瓶FeCl2溶液,某同学欲检验该溶液是否已经变质,首先取适量溶液于洁净的试管中,然后向溶液中滴加几滴______________ ,观察溶液是否变成红色即可得出结论。
(3)FeCl3与氢碘酸混合时有棕色物质生成,写出该反应的离子方程式:________ ;工业上还可以用FeCl3溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是____________ 。(填序号)。
A.若无固体剩余,则溶液中可能含有 、
、 、
、 、
、 四种离子
四种离子
B.若溶液中有 ,则体系中一定没有固体剩余
,则体系中一定没有固体剩余
C.若有固体剩余,则溶液中一定有反应 发生
发生
D.当溶液中有 存在时,则一定没有
存在时,则一定没有 析出
析出
(4)高铁酸钾( )是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在
)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在 中铁元素的化合价为
中铁元素的化合价为_________ , 与
与 在强碱性条件下反应可制取
在强碱性条件下反应可制取 ,其反应的离子方程式为
,其反应的离子方程式为________ 。
(1)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物
 的化学式。实验中称取0.54g的
的化学式。实验中称取0.54g的 样品,溶解后先进行阳离子交换预处理,再通过含有饱和
样品,溶解后先进行阳离子交换预处理,再通过含有饱和 的阴离子交换柱,使
的阴离子交换柱,使 和
和 发生交换。交换完成后,流出溶液的
发生交换。交换完成后,流出溶液的 用
用 的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出
的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出 中x的值为
中x的值为(2)在实验室中,FeCl2可用铁粉和
(3)FeCl3与氢碘酸混合时有棕色物质生成,写出该反应的离子方程式:
A.若无固体剩余,则溶液中可能含有
 、
、 、
、 、
、 四种离子
四种离子B.若溶液中有
 ,则体系中一定没有固体剩余
,则体系中一定没有固体剩余C.若有固体剩余,则溶液中一定有反应
 发生
发生D.当溶液中有
 存在时,则一定没有
存在时,则一定没有 析出
析出(4)高铁酸钾(
 )是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在
)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在 中铁元素的化合价为
中铁元素的化合价为 与
与 在强碱性条件下反应可制取
在强碱性条件下反应可制取 ,其反应的离子方程式为
,其反应的离子方程式为
您最近一年使用:0次



