1 . 下列方案设计、现象和结论有不正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验某溶液中是否存在 | 取无锈铁丝用稀硫酸洗净,在外焰上灼烧至与原火焰颜色相同后,蘸取溶液做同样操作,透过蓝色钴玻璃片观察现象 | 若观察到紫色火焰,则溶中存在 |
| B | 探究 固体样品是否变质 固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液 溶液 | 若有白色沉淀产生,则样品已经变质 |
| C | 探究淀粉的水解 | 在试管中加入0.5g淀粉和4mL2mol/L 溶液,加热。冷却后加入少量新制 溶液,加热。冷却后加入少量新制 ,加热,观察现象 ,加热,观察现象 | 若未出现砖红色沉淀,不能说明淀粉未水解 |
| D | 探究 的性质 的性质 | 在稀 中加入少量 中加入少量 (s),观察现象 (s),观察现象 | 若溶液由无色变为蓝色并有红色固体生成,则反应中 既作氧化剂又作还原剂 既作氧化剂又作还原剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 氯化亚铜(CuCl)广泛应用于有机合成、燃料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及部分实验装置图。
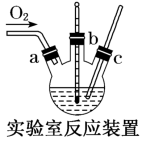
实验药品:铜丝20g(过量)、氯化铵20g、65% 浓硝酸10mL、36%盐酸15mL、水。
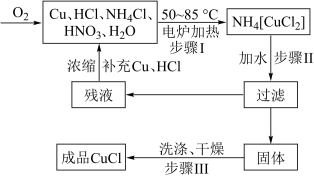
(1)实验流程中先制得NH4[CuCl2],再将其溶于水制得氯化亚铜,请写出步骤II的化学方程式___________ ;不采用一步法(一步法为:Cu2++Cu+2Cl-=2CuCl)制得CuCl的理由是___________
(2)步骤I中电炉加热升温至50℃时停止加热,反应快速进行,当三颈烧瓶中液面上方的现象为___________ 时,反应已完成,停止通入氧气。打开瓶塞,沿C口倾出反应液于1000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(3)关于该实验过程中,下列说法正确的是___________
A.混合Cu、NH4Cl、HCl和HNO3时,温度计显示反应液温度可能低于室温。
B.步骤III中过滤操作,可采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C.该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D.反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(4)实验室还可以通过在CuCl2热溶液中通入SO2气体制备白色氯化亚铜沉淀,试写出该反应的离子方程式___________
(5)氯化亚铜的定量分析:
①称取成品0.2500g置于预先放入玻璃珠30粒和10 mL过量的FeCl3溶液的250 mL锥形瓶中,不断摇动;待样品溶解后,加水50 mL,邻菲罗啉指示剂2滴;立即用0.1000 mol·L-1硫酸铈[Ce(SO4)2]标准溶液滴至终点。在此过程中要用到滴定管,选出其正确操作并按序列出字母:检漏→___________ →___________ →___________ →___________ →___________ ,滴定管准备完成。
(已知CuCl+ Fe3+=Cu2++Fe2++Cl-,Fe2++Ce4+=Fe3++Ce3+)
a.用蒸馏水洗涤滴定管
b.调整液面至“0”刻度或“0”刻度以下,记录数据
c.用硫酸铈溶液润洗滴定管
d.用烧杯量取一定量硫酸铈溶液,从滴定管上口加入至高于“0”刻度
e.略微倾斜滴定管,轻轻转动活塞使滴定管的尖嘴部分充满溶液至无气泡
f.滴定管尖向上弯曲,轻轻挤压玻璃珠使滴定管的尖嘴部分充满溶液至无气泡
②当滴入最后一滴硫酸铈溶液时,溶液呈现绿色,且30s不褪色,并记录读数,再重复实验2次,测得数据如下表。
计算CuCl的纯度___________

实验药品:铜丝20g(过量)、氯化铵20g、65% 浓硝酸10mL、36%盐酸15mL、水。

(1)实验流程中先制得NH4[CuCl2],再将其溶于水制得氯化亚铜,请写出步骤II的化学方程式
(2)步骤I中电炉加热升温至50℃时停止加热,反应快速进行,当三颈烧瓶中液面上方的现象为
(3)关于该实验过程中,下列说法正确的是
A.混合Cu、NH4Cl、HCl和HNO3时,温度计显示反应液温度可能低于室温。
B.步骤III中过滤操作,可采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C.该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D.反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(4)实验室还可以通过在CuCl2热溶液中通入SO2气体制备白色氯化亚铜沉淀,试写出该反应的离子方程式
(5)氯化亚铜的定量分析:
①称取成品0.2500g置于预先放入玻璃珠30粒和10 mL过量的FeCl3溶液的250 mL锥形瓶中,不断摇动;待样品溶解后,加水50 mL,邻菲罗啉指示剂2滴;立即用0.1000 mol·L-1硫酸铈[Ce(SO4)2]标准溶液滴至终点。在此过程中要用到滴定管,选出其正确操作并按序列出字母:检漏→
(已知CuCl+ Fe3+=Cu2++Fe2++Cl-,Fe2++Ce4+=Fe3++Ce3+)
a.用蒸馏水洗涤滴定管
b.调整液面至“0”刻度或“0”刻度以下,记录数据
c.用硫酸铈溶液润洗滴定管
d.用烧杯量取一定量硫酸铈溶液,从滴定管上口加入至高于“0”刻度
e.略微倾斜滴定管,轻轻转动活塞使滴定管的尖嘴部分充满溶液至无气泡
f.滴定管尖向上弯曲,轻轻挤压玻璃珠使滴定管的尖嘴部分充满溶液至无气泡
②当滴入最后一滴硫酸铈溶液时,溶液呈现绿色,且30s不褪色,并记录读数,再重复实验2次,测得数据如下表。
| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
您最近一年使用:0次
3 . Ⅰ.绿色粉末状固体化合物X由三种元素组成,取50.4gX,用蒸馏水完全溶解得绿色溶液A,将溶液A分成A1和A2两等份,完成如下实验:
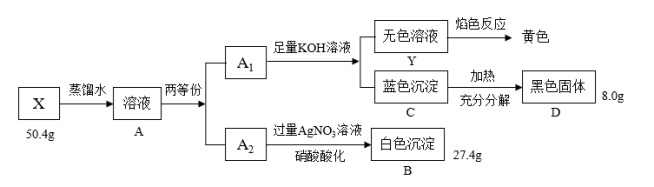
请回答
(1)X的化学式是____ 。
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:____ 。
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式____ 。
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:

请回答
(1)该套实验装置的明显缺陷是____ 。
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中____ (填实验现象),则可证明三草酸合铁酸钾热分解的气体产物是H2O、CO、CO2。
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:____ 。

请回答
(1)X的化学式是
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:

请回答
(1)该套实验装置的明显缺陷是
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:
您最近一年使用:0次
2020-11-30更新
|
329次组卷
|
2卷引用:浙江省十校联盟2021届高三10月联考化学试题
19-20高二·浙江·阶段练习
解题方法
4 . 0.80gCuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
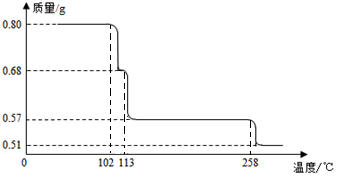
(1)试通过计算确定200℃时固体物质的化学式__________ ;
(2)取270℃所得样品,于570℃灼烧得到的两种产物,黑色粉末和气体,该反应的化学方程式为___________ 。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体存在的最高温度是_____________ 。
请回答下列问题:

(1)试通过计算确定200℃时固体物质的化学式
(2)取270℃所得样品,于570℃灼烧得到的两种产物,黑色粉末和气体,该反应的化学方程式为
您最近一年使用:0次
5 . 氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
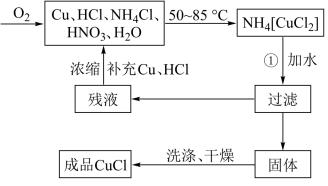
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________ 。
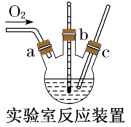
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____ (填字母序号)方案,并说明选择该装置的理由__________________________________________ 。
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____ 时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________ 。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量分析:
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2,Fe2+ + Ce4+ = Fe3+ + Ce3+)
④数据处理:计算得CuCl的纯度为__________ 。


实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式
(2)本实验中通入O2的速率不宜过大,宜选择下图中的

(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为
(4)关于该实验过程中,下列说法正确的是
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量分析:
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2,Fe2+ + Ce4+ = Fe3+ + Ce3+)
| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
您最近一年使用:0次
2019-08-10更新
|
853次组卷
|
3卷引用:浙江省诸暨中学2018-2019学年高二(实验班)下学期期中考试化学试题



