名校
解题方法
1 . 碱式碳酸铜[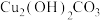 ,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为
,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
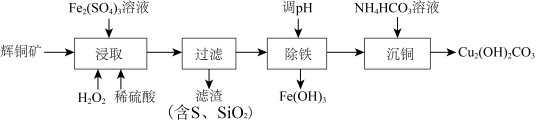
(1)“浸取”时能提高辉铜矿Cu浸取率的措施有___________ (填2条)
(2)某小组测得Cu浸取率随 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:

①由图一可知 适宜的浓度范围为
适宜的浓度范围为___________ ;
②由图一中的a点分析,浸取时 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为___________ 。
③图二中高于85℃时Cu浸取率下降的原因是___________ 。
(3)①“除铁”步骤调pH可加入试剂___________ (填选项字母);
a.HCl b.NaOH c.CuO d.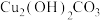
②常温下,“过滤”后的滤液中 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于___________ 。[常温下,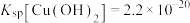 ]。
]。
(4)某实验小组为测定碱式碳酸铜的纯度,取制得的碱式碳酸铜产品5.0g,加适量硫酸,再加100mL水,加热溶解,冷却后配成250mL溶液。量取配成的25.00mL溶液于碘量瓶中,加入适量缓冲溶液控制溶液的pH在3~4之间,以及过量的碘化钾,摇匀,于暗处放置5分钟。用 的
的 溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入
溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入 溶液至滴定终点。平行测定3次,实验数据如下表所示。
溶液至滴定终点。平行测定3次,实验数据如下表所示。
已知: ,
,
①判断滴定到达终点的现象是___________ ;
②根据表中数据计算实验小组制得的碱式碳酸铜的纯度为___________ 。
(5)对下列几种假定情况进行讨论(填“偏高”、“偏低”或“无影响”);
①装 溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是
溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是___________ ;
②读 溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是
溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是___________ 。
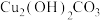 ,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为
,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
(1)“浸取”时能提高辉铜矿Cu浸取率的措施有
(2)某小组测得Cu浸取率随
 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:
①由图一可知
 适宜的浓度范围为
适宜的浓度范围为②由图一中的a点分析,浸取时
 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为③图二中高于85℃时Cu浸取率下降的原因是
(3)①“除铁”步骤调pH可加入试剂
a.HCl b.NaOH c.CuO d.
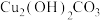
②常温下,“过滤”后的滤液中
 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于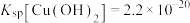 ]。
]。(4)某实验小组为测定碱式碳酸铜的纯度,取制得的碱式碳酸铜产品5.0g,加适量硫酸,再加100mL水,加热溶解,冷却后配成250mL溶液。量取配成的25.00mL溶液于碘量瓶中,加入适量缓冲溶液控制溶液的pH在3~4之间,以及过量的碘化钾,摇匀,于暗处放置5分钟。用
 的
的 溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入
溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入 溶液至滴定终点。平行测定3次,实验数据如下表所示。
溶液至滴定终点。平行测定3次,实验数据如下表所示。已知:
 ,
,
| 实验编号 | 滴定前 溶液的体积读数/mL 溶液的体积读数/mL | 滴定后 溶液的体积读数/mL 溶液的体积读数/mL |
| 1 | 0.10 | 20.12 |
| 2 | 1.20 | 23.21 |
| 3 | 1.50 | 21.48 |
②根据表中数据计算实验小组制得的碱式碳酸铜的纯度为
(5)对下列几种假定情况进行讨论(填“偏高”、“偏低”或“无影响”);
①装
 溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是
溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是②读
 溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是
溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是
您最近一年使用:0次
解题方法
2 . 最近我国有人报道,将0.1 mol· L-1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol· L-1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得浑浊。
(1)设此装置中发生的是铜离子和硫离子直接相遇的反应,已知 (Cu2+/Cu)和
(Cu2+/Cu)和 (S/S2-)分别为0.345 V和-0.476V, nF
(S/S2-)分别为0.345 V和-0.476V, nF =RTlnK,
=RTlnK, 表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数
表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数____ ,写出平衡常数表达式______ 。
(2)金属铜和浑浊现象均出现在蛋壳外,这意味着____ 。
(3)该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH=6,写出反应的离子方程式______ 。
(4)请对此实验结果作一简短评论____ 。
(1)设此装置中发生的是铜离子和硫离子直接相遇的反应,已知
 (Cu2+/Cu)和
(Cu2+/Cu)和 (S/S2-)分别为0.345 V和-0.476V, nF
(S/S2-)分别为0.345 V和-0.476V, nF =RTlnK,
=RTlnK, 表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数
表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数(2)金属铜和浑浊现象均出现在蛋壳外,这意味着
(3)该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH=6,写出反应的离子方程式
(4)请对此实验结果作一简短评论
您最近一年使用:0次
2021·福建福州·二模
名校
解题方法
3 . 甲醛与新制氢氧化铜反应的产物随反应条件改变而有所不同。实验室对该反应在一定条件下所得产物成分进行探究,具体过程如下。
取一定量的NaOH溶液、CuSO4溶液和甲醛于锥形瓶,控制温度40-50℃回流1h,收集到大量气体X,并有红色沉淀生成。
(1)①“控制温度40-50℃”的常用加热方法是_______ 。
②气体X能燃烧且完全燃烧产物不会使澄清石灰水变浑浊,说明该气体是_______ 。
(2)在探究甲醛的氧化产物时,发现未生成 。为了进一步确定,甲醛是否被氧化为HCOONa,进行如图实验(图中省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
。为了进一步确定,甲醛是否被氧化为HCOONa,进行如图实验(图中省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
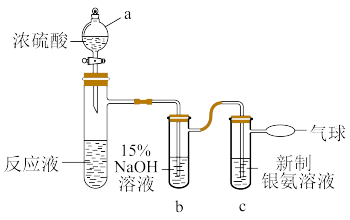
①仪器a的名称是_______ 。
②b中,NaOH溶液的作用是_______ 。
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为_______ 。
(3)① 没有颜色,易被氧化,可由Cu2O溶于氨水而得。红色沉淀用浓氨水充分浸取后未明显减少,得到蓝色溶液。使溶液呈蓝色的微粒是
没有颜色,易被氧化,可由Cu2O溶于氨水而得。红色沉淀用浓氨水充分浸取后未明显减少,得到蓝色溶液。使溶液呈蓝色的微粒是_______ 。
②另取1.00g红色沉淀,用适量稀盐酸、双氧水溶解完全,加热煮沸溶液4-5min,冷却后加入过量的碘化钾溶液和淀粉指示剂,再用1.000 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液15.50mL。因此,红色沉淀中Cu单质的质量分数
_______ (结果保留3位有效数字;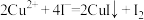 ;
;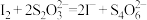 。)
。)
(4)若最终测得沉淀中Cu单质和气体产物物质的量比为1∶1,该条件下甲醛与新制氢氧化铜发生的主要反应化学方程式为_______ 。
取一定量的NaOH溶液、CuSO4溶液和甲醛于锥形瓶,控制温度40-50℃回流1h,收集到大量气体X,并有红色沉淀生成。
(1)①“控制温度40-50℃”的常用加热方法是
②气体X能燃烧且完全燃烧产物不会使澄清石灰水变浑浊,说明该气体是
(2)在探究甲醛的氧化产物时,发现未生成
 。为了进一步确定,甲醛是否被氧化为HCOONa,进行如图实验(图中省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
。为了进一步确定,甲醛是否被氧化为HCOONa,进行如图实验(图中省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
①仪器a的名称是
②b中,NaOH溶液的作用是
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为
(3)①
 没有颜色,易被氧化,可由Cu2O溶于氨水而得。红色沉淀用浓氨水充分浸取后未明显减少,得到蓝色溶液。使溶液呈蓝色的微粒是
没有颜色,易被氧化,可由Cu2O溶于氨水而得。红色沉淀用浓氨水充分浸取后未明显减少,得到蓝色溶液。使溶液呈蓝色的微粒是②另取1.00g红色沉淀,用适量稀盐酸、双氧水溶解完全,加热煮沸溶液4-5min,冷却后加入过量的碘化钾溶液和淀粉指示剂,再用1.000 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液15.50mL。因此,红色沉淀中Cu单质的质量分数

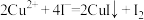 ;
;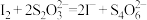 。)
。)(4)若最终测得沉淀中Cu单质和气体产物物质的量比为1∶1,该条件下甲醛与新制氢氧化铜发生的主要反应化学方程式为
您最近一年使用:0次
2021-04-10更新
|
793次组卷
|
3卷引用:第16讲 醛和酮(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)
(已下线)第16讲 醛和酮(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)福建省福州市2021届高中毕业班4月质量检测化学试题广东省广州市广东实验中学2023届高三上学期第二次阶段考试化学试题
名校
4 . 某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含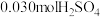 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
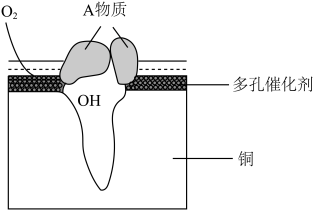
(1)该粉状锈中除了铜元素外还含有(写元素符号)___ 元素,该铜制品发生电化学腐蚀生成粉状锈时其正极电极反应式为____ 。
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____ 。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为____ 。
实验①:取A样品,加过量稀硝酸完全溶解后,再加入
 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。实验②:另取A样品4.29g,加入含
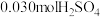 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
(1)该粉状锈中除了铜元素外还含有(写元素符号)
(2)写出该粉状锈溶于稀硫酸反应的离子方程式
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为
您最近一年使用:0次
2011·内蒙古呼伦贝尔·二模
解题方法
5 . 用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
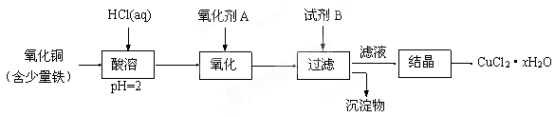
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
(1)加热酸溶过程中发生反应的化学方程式有:____________ 。
(2)氧化剂A可选用_________ (填编号,下同)。
A.KMnO4 B. HNO3 C. Cl2
(3)要得到较纯的产品,试剂B可选用_________ 。
A. NaOH B. CuO C.FeO
(4)试剂B的作用是__________ 。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
(5)从滤液经过结晶得到氯化铜晶体的实验条件是___________ 。

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
(1)加热酸溶过程中发生反应的化学方程式有:
(2)氧化剂A可选用
A.KMnO4 B. HNO3 C. Cl2
(3)要得到较纯的产品,试剂B可选用
A. NaOH B. CuO C.FeO
(4)试剂B的作用是
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
(5)从滤液经过结晶得到氯化铜晶体的实验条件是
您最近一年使用:0次



