名校
解题方法
1 . 三星堆出土的青铜面具,由于时间久远,表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、 、
、 作用产生的,其化学式为
作用产生的,其化学式为 ,请用学过的方法对其展开探究。
,请用学过的方法对其展开探究。
(1)根据以上信息可知 的物理性质(写“色、态”)
的物理性质(写“色、态”)___________ 。
(2)为了探究物质的性质,先要了解物质所属的类别,从不同分类标准分析“铜绿”不属于_______ 。
A.铜盐 B.碳酸盐 C.碱式盐 D.碱 E.含氧酸盐 F.无氧酸盐
(3)你从“铜绿”的组成和类别预测它可能具有的性质是___________ (如热稳定性或与哪些物质反应,任写2点)。
(4)经过实验探究,以“铜绿”为反应物可以实现以下物质转化:
“铜绿 ”
”
经观察反应①固体物质溶解,有气泡产生,写出反应方程式___________ 。写出②可能的化学方程式___________ 。
③反应属于___________ 反应(填基本反应类型)。写出④可能的化学方程式___________ 。
 、
、 作用产生的,其化学式为
作用产生的,其化学式为 ,请用学过的方法对其展开探究。
,请用学过的方法对其展开探究。(1)根据以上信息可知
 的物理性质(写“色、态”)
的物理性质(写“色、态”)(2)为了探究物质的性质,先要了解物质所属的类别,从不同分类标准分析“铜绿”不属于
A.铜盐 B.碳酸盐 C.碱式盐 D.碱 E.含氧酸盐 F.无氧酸盐
(3)你从“铜绿”的组成和类别预测它可能具有的性质是
(4)经过实验探究,以“铜绿”为反应物可以实现以下物质转化:
“铜绿
 ”
”经观察反应①固体物质溶解,有气泡产生,写出反应方程式
③反应属于
您最近一年使用:0次
名校
解题方法
2 . 胆矾(或蓝矾)在日常生活中有广泛应用,如配制农药波尔多液、作游泳池的消毒剂。某小组以辉铜矿粉(主要成分是 ) 为原料制备胆矾及副产品的简易流程如下:
) 为原料制备胆矾及副产品的简易流程如下:
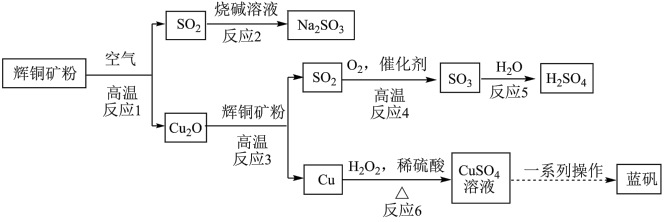
请回答下列问题:
(1)胆矾的相对分子质量为___________ 。
(2)反应1中被氧化的元素为___________ (填元素符号);在上述反应1~6中属于氧化还原反应的有___________ 个(填数字)。
(3)反应3的化学方程式为:___________ 。
(4)反应6的离子方程式为:___________ 。
(5) 在空气中易氧化变质生成
在空气中易氧化变质生成___________ (填化学式)。
(6)已知胆矾的溶解度随温度变化如图所示。

从 溶液中提取胆矾,采用“一系列操作”包括蒸发浓缩、
溶液中提取胆矾,采用“一系列操作”包括蒸发浓缩、___________ 、过滤、洗涤、低温干燥。
 ) 为原料制备胆矾及副产品的简易流程如下:
) 为原料制备胆矾及副产品的简易流程如下:
请回答下列问题:
(1)胆矾的相对分子质量为
(2)反应1中被氧化的元素为
(3)反应3的化学方程式为:
(4)反应6的离子方程式为:
(5)
 在空气中易氧化变质生成
在空气中易氧化变质生成(6)已知胆矾的溶解度随温度变化如图所示。

从
 溶液中提取胆矾,采用“一系列操作”包括蒸发浓缩、
溶液中提取胆矾,采用“一系列操作”包括蒸发浓缩、
您最近一年使用:0次
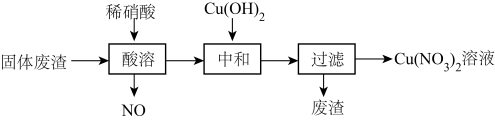
3 . 某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2。利用该固体废渣制取Cu(NO3)2溶液的工艺流程如图所示:
②SiO2是酸性氧化物,难于水和酸。
(1)写出Cu2O与稀硝酸反应的离子反应方程式为___________ ;
(2)酸溶时,反应温度不宜超过70℃,其主要原因是___________ ;
(3)将酸溶步骤排放的NO循环利用既环保又能提高产量,具体操作流程是___________ ;
(4)酸溶试剂改用绿色氧化剂(10%H2O2和20%稀硝酸的混合液),基本无氮氧化物排放,写出废渣中Cu与绿色氧化剂反应的离子反应方程式___________ ;
(5)中和试剂选择Cu(OH)2,若改为NaOH,缺点是___________ ;
(6)以某工业废水(主要含Cu2+、Na+、SO )为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入
)为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入___________ ,洗涤,干燥。(须使用的试剂有:蒸馏水、1mol/L NaOH溶液、1mol/LHNO3溶液;Cu(NO3)2的溶解度曲线如图所示。)
②SiO2是酸性氧化物,难于水和酸。
(1)写出Cu2O与稀硝酸反应的离子反应方程式为
(2)酸溶时,反应温度不宜超过70℃,其主要原因是
(3)将酸溶步骤排放的NO循环利用既环保又能提高产量,具体操作流程是
(4)酸溶试剂改用绿色氧化剂(10%H2O2和20%稀硝酸的混合液),基本无氮氧化物排放,写出废渣中Cu与绿色氧化剂反应的离子反应方程式
(5)中和试剂选择Cu(OH)2,若改为NaOH,缺点是
(6)以某工业废水(主要含Cu2+、Na+、SO
 )为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入
)为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入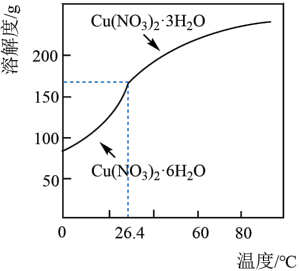
您最近一年使用:0次
2023-10-04更新
|
510次组卷
|
2卷引用:江苏省扬州中学2022-2023学年高一下学期3月月考化学试题
4 . 在初中化学“金属的性质”中有如下实验:将无锈铁钉浸入CuSO4溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
【提出问题】Al和CuSO4溶液也能发生化学反应吗?
(1)预测Al能和CuSO4溶液反应,理由是_______ 。
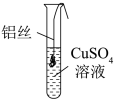
【进行实验】将一端缠绕的铝丝浸入CuSO4溶液(如图),观察现象。
(2)铝丝表面未出现红色物质,原因是_______ (用化学方程式解释)。
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入CuSO4溶液,观察现象。
(3)填写实验报告单:
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;②Cl-可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为_______ 。
(5)欲加快Al和CuSO4溶液的反应,可加入的物质是_______ (填一种即可)。
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是_______(填序号)。
【提出问题】Al和CuSO4溶液也能发生化学反应吗?
(1)预测Al能和CuSO4溶液反应,理由是
【进行实验】将一端缠绕的铝丝浸入CuSO4溶液(如图),观察现象。

(2)铝丝表面未出现红色物质,原因是
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入CuSO4溶液,观察现象。
(3)填写实验报告单:
| 序号 | 实验现象 | 结论与解释 |
| ① | 铝丝表面有少量气泡;铝丝周围出现蓝绿色物质 | CuSO4溶液呈弱酸性,与Al反应产生的气体是 |
| ② | 24h后,铝丝仍光亮;48h后,铝丝表面出现少量红色物质 | 红色物质是 |
| ③ | 铝丝周围溶液逐渐变成无色,铝丝以下溶液仍为蓝色:两层溶液界面清晰 | 反应生成的Al2(SO4)3为无色;Al2(SO4)3溶液的密度 |
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;②Cl-可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为
(5)欲加快Al和CuSO4溶液的反应,可加入的物质是
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是_______(填序号)。
| A.食醋 | B.食用油 | C.面粉 | D.咸菜 |
您最近一年使用:0次
名校
5 . 为探究固体化合物X(仅含两种元素,100 g/mol<M<200 g/mol)的组成和性质,设计并完成如下实验:
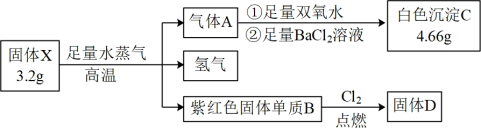
已知:气体A能使品红溶液褪色。请回答:
(1)固体D的化学式是___________ 。
(2)固体X的所含的元素是___________ 。(填元素符号)
(3)氢气是一种理想的绿色能源,点燃前须进行的操作是___________ 。
(4)写出气体A与双氧水反应的化学方程式___________ 。

已知:气体A能使品红溶液褪色。请回答:
(1)固体D的化学式是
(2)固体X的所含的元素是
(3)氢气是一种理想的绿色能源,点燃前须进行的操作是
(4)写出气体A与双氧水反应的化学方程式
您最近一年使用:0次
名校
6 . 学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
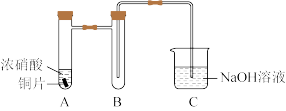
(1)铜与浓硝酸反应的装置如图,A中反应的离子方程式为______ ,装置B的作用为______ 。
(2)铜与过量 反应的探究如下:
反应的探究如下:

实验②中Cu溶解的离子方程式为______ ;产生的气体为______ 。比较实验①和②,从氧化还原角度说明H⁺的作用是______ 。
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m g X完全分解为n g黑色氧化物Y,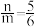 。X的化学式为
。X的化学式为______ 。
(4)取含X粗品0.0500 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.1000 mol⋅L
 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液15.00 mL。(已知:
标准溶液15.00 mL。(已知: ,
, )粗品中X的百分含量
)粗品中X的百分含量______ %。
(1)铜与浓硝酸反应的装置如图,A中反应的离子方程式为

(2)铜与过量
 反应的探究如下:
反应的探究如下:
实验②中Cu溶解的离子方程式为
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m g X完全分解为n g黑色氧化物Y,
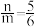 。X的化学式为
。X的化学式为(4)取含X粗品0.0500 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.1000 mol⋅L

 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液15.00 mL。(已知:
标准溶液15.00 mL。(已知: ,
, )粗品中X的百分含量
)粗品中X的百分含量
您最近一年使用:0次
名校
7 . 回答下列问题:
(1) 可用作有机合成的催化剂。
可用作有机合成的催化剂。 是一种难溶于水和乙醇的白色固体,露置于潮湿空气中易被氧化。
是一种难溶于水和乙醇的白色固体,露置于潮湿空气中易被氧化。
次磷酸 是一种强还原剂,将它加入
是一种强还原剂,将它加入 水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH,次磷酸转化为磷酸。待CuH生成后将HCl气体通入,可产生
水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH,次磷酸转化为磷酸。待CuH生成后将HCl气体通入,可产生 。写出生成CuH的化学方程式:
。写出生成CuH的化学方程式:___________ 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、 、
、 和
和 的百分组成。
的百分组成。 的盐酸溶液能吸收CO形成
的盐酸溶液能吸收CO形成 。
。
ii.保险粉 和KOH的混合溶液能吸收氧气。
和KOH的混合溶液能吸收氧气。
请回答以下问题:
①G中测出的是___________ (填物质的化学式)的体积。
②F洗气瓶中宜盛放的试剂是___________ 。
(3)工业上可以在酸性介质中用 氧化浸出黄铜矿
氧化浸出黄铜矿 。
。
① 反应后转化为
反应后转化为 、
、 、
、 。将
。将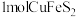 完全转化,理论上所需
完全转化,理论上所需 的物质的量为
的物质的量为___________ 。
②浸出过程中发现, 的反应实际用量远大于理论用量,原因是
的反应实际用量远大于理论用量,原因是___________ 。
③若浸出过程中,溶液中含有少量 ,则会析出黄钠铁矾
,则会析出黄钠铁矾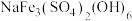 沉淀。写出
沉淀。写出 转化为黄钠铁矾沉淀的离子方程式:
转化为黄钠铁矾沉淀的离子方程式:___________ 。
(1)
 可用作有机合成的催化剂。
可用作有机合成的催化剂。 是一种难溶于水和乙醇的白色固体,露置于潮湿空气中易被氧化。
是一种难溶于水和乙醇的白色固体,露置于潮湿空气中易被氧化。次磷酸
 是一种强还原剂,将它加入
是一种强还原剂,将它加入 水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH,次磷酸转化为磷酸。待CuH生成后将HCl气体通入,可产生
水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH,次磷酸转化为磷酸。待CuH生成后将HCl气体通入,可产生 。写出生成CuH的化学方程式:
。写出生成CuH的化学方程式:(2)某同学利用如下图所示装置,测定高炉煤气中CO、
 、
、 和
和 的百分组成。
的百分组成。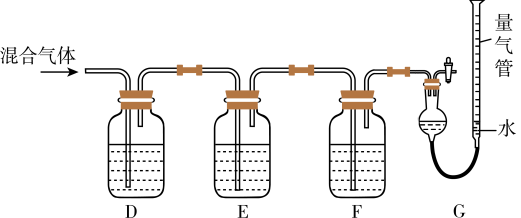
 的盐酸溶液能吸收CO形成
的盐酸溶液能吸收CO形成 。
。ii.保险粉
 和KOH的混合溶液能吸收氧气。
和KOH的混合溶液能吸收氧气。请回答以下问题:
①G中测出的是
②F洗气瓶中宜盛放的试剂是
(3)工业上可以在酸性介质中用
 氧化浸出黄铜矿
氧化浸出黄铜矿 。
。①
 反应后转化为
反应后转化为 、
、 、
、 。将
。将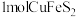 完全转化,理论上所需
完全转化,理论上所需 的物质的量为
的物质的量为②浸出过程中发现,
 的反应实际用量远大于理论用量,原因是
的反应实际用量远大于理论用量,原因是③若浸出过程中,溶液中含有少量
 ,则会析出黄钠铁矾
,则会析出黄钠铁矾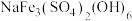 沉淀。写出
沉淀。写出 转化为黄钠铁矾沉淀的离子方程式:
转化为黄钠铁矾沉淀的离子方程式:
您最近一年使用:0次
名校
8 . 兴趣小组通过实验探究溶解铜的方法和本质。
(1)将铜粉分别加到稍过量的氯化铁溶液和硫酸铁溶液中,铜粉溶解,溶液变成浅绿色,两个反应的共同点是(用离子方程式表示)_______ 。
(2)在热水浴中进行4个实验,部分实验报告如下表所示。
①实验操作Ⅲ是_______ 。
②实验I、Ⅱ、Ⅲ的目的是_______ 。
③实验Ⅳ中反应的本质是(用离子方程式表示)_______ 。
(3)将铜粉加到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是_______ 。
(1)将铜粉分别加到稍过量的氯化铁溶液和硫酸铁溶液中,铜粉溶解,溶液变成浅绿色,两个反应的共同点是(用离子方程式表示)
(2)在热水浴中进行4个实验,部分实验报告如下表所示。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入铜片 | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入铜片 | 无明显变化 |
| Ⅲ | 无明显变化 | |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入铜片 | 有无色气泡;溶液变蓝 |
②实验I、Ⅱ、Ⅲ的目的是
③实验Ⅳ中反应的本质是(用离子方程式表示)
(3)将铜粉加到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是
您最近一年使用:0次
9 . 某小组设计实验证明乙醇和钠反应产生氢气,并探究氧化铜的还原产物。
已知:① 。
。
②红色粉末 在酸性条件下发生歧化反应:
在酸性条件下发生歧化反应: 。
。
装置如图所示:
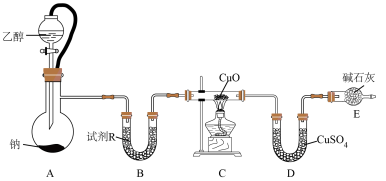
回答下列问题:
(1)试剂R最好选择__________(填字母)。
(2)装置E的作用是__________ 。
(3)实验完毕后,为了探究C中红色粉末是否含有 ,设计下列两种方案:
,设计下列两种方案:
方案1:取少量红色粉末于试管,加入足量溶液M,充分振荡,若溶液变蓝色,则红色粉末一定含 ;
;
方案2:取ag红色粉末,在加热条件下通入足量氢气,充分反应后,冷却、称重,红色固体质量为xg。
①方案1中M可能是__________ 。
A.稀硝酸 B.稀硫酸 C.浓硫酸 D.浓硝酸
②方案2中,当
__________ 时,红色粉末全部是 。
。
(4)分析与讨论。
①CuO被 、
、 、CO等还原可能生成
、CO等还原可能生成 或Cu,生成
或Cu,生成 的可能原因是
的可能原因是__________ 。
A.通入 量不足 B.
量不足 B. 与CuO接触充分
与CuO接触充分
C.温度较低 D.温度过高
②若缺少装置B,C中黑色粉末变红色,D中白色粉末变蓝色,不能肯定A中一定生成了 ,用化学方程式表达其理由
,用化学方程式表达其理由__________ 。
已知:①
 。
。②红色粉末
 在酸性条件下发生歧化反应:
在酸性条件下发生歧化反应: 。
。装置如图所示:

回答下列问题:
(1)试剂R最好选择__________(填字母)。
| A.碱石灰 | B.无水氯化钙 | C.五氧化二磷 | D.硫酸镁 |
(3)实验完毕后,为了探究C中红色粉末是否含有
 ,设计下列两种方案:
,设计下列两种方案:方案1:取少量红色粉末于试管,加入足量溶液M,充分振荡,若溶液变蓝色,则红色粉末一定含
 ;
;方案2:取ag红色粉末,在加热条件下通入足量氢气,充分反应后,冷却、称重,红色固体质量为xg。
①方案1中M可能是
A.稀硝酸 B.稀硫酸 C.浓硫酸 D.浓硝酸
②方案2中,当

 。
。(4)分析与讨论。
①CuO被
 、
、 、CO等还原可能生成
、CO等还原可能生成 或Cu,生成
或Cu,生成 的可能原因是
的可能原因是A.通入
 量不足 B.
量不足 B. 与CuO接触充分
与CuO接触充分C.温度较低 D.温度过高
②若缺少装置B,C中黑色粉末变红色,D中白色粉末变蓝色,不能肯定A中一定生成了
 ,用化学方程式表达其理由
,用化学方程式表达其理由
您最近一年使用:0次
10 . 工业上由含铜废料(含有 、
、 、
、 等)制备硝酸铜晶体的流程如图:
等)制备硝酸铜晶体的流程如图:
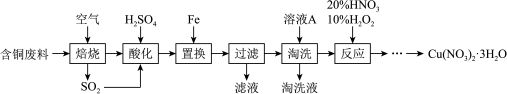
(1)写出CuS“焙烧”生成SO2和CuO的化学反应方程式:_______
(2)“过滤”后需洗涤沉淀,请设计实验证明已洗涤干净_______
(3)“淘洗”所用的溶液A应选用_______ (填序号)a.稀硫酸b.浓硫酸c.稀硝酸d.浓硝酸
(4)“反应”步骤加10%H2O2可以避免污染性气体的产生,写出该反应的离子方程式:_______ ,也可以用气体_______ (填化学式)代替双氧水
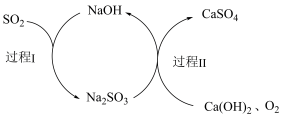
(5)大量排放SO2容易造成酸雨等环境问题,工业上可用双碱脱硫法处理废气,过程如图所示,写出双碱脱硫法的总反应方程式:_______
(6)已知:混合气体为SO2与N2的混合气体,为测定SO2在混合气体中的体积分数,实验小组设计了如图实验方案:
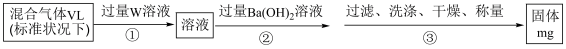
①W溶液可以是_______ (填标号)。
a.H2O2溶液 b.酸性KMnO4溶液 c.氯水
②该混合气体中气体SO2的体积分数为_______ (用含V、m的式子表示)
 、
、 、
、 等)制备硝酸铜晶体的流程如图:
等)制备硝酸铜晶体的流程如图:
(1)写出CuS“焙烧”生成SO2和CuO的化学反应方程式:
(2)“过滤”后需洗涤沉淀,请设计实验证明已洗涤干净
(3)“淘洗”所用的溶液A应选用
(4)“反应”步骤加10%H2O2可以避免污染性气体的产生,写出该反应的离子方程式:
(5)大量排放SO2容易造成酸雨等环境问题,工业上可用双碱脱硫法处理废气,过程如图所示,写出双碱脱硫法的总反应方程式:

(6)已知:混合气体为SO2与N2的混合气体,为测定SO2在混合气体中的体积分数,实验小组设计了如图实验方案:
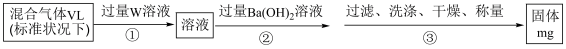
①W溶液可以是
a.H2O2溶液 b.酸性KMnO4溶液 c.氯水
②该混合气体中气体SO2的体积分数为
您最近一年使用:0次



