1 . 现有一包固体混合物其中可能含有硝酸铵、硫酸钾、硝酸铜、碳酸钠、硝酸钡等几种物质中的一种或多种。现对其进行检验,出现的现象如图所述(假设过程中所有发生的反应都恰好完全反应)。请你依据实验过程和产生的现象做出分析与判断:

(1)气体A的化学式为_____ 。(填化学式,下同)
(2)该固体混合物中一定含有的物质是_____ ,一定不含的物质是_____ 。
(3)若向沉淀D中加足量稀盐酸观察到沉淀部分溶解并生成一种能使澄清石灰水变浑浊的气体,则该反应的化学方程式为_____ 。

(1)气体A的化学式为
(2)该固体混合物中一定含有的物质是
(3)若向沉淀D中加足量稀盐酸观察到沉淀部分溶解并生成一种能使澄清石灰水变浑浊的气体,则该反应的化学方程式为
您最近一年使用:0次
2 . 回答下列问题
(1)下图为铁及其化合物的“价-类”二维图。
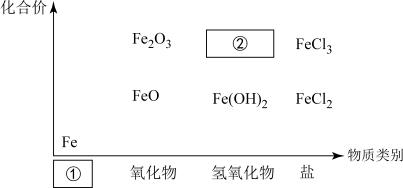
填写二维图缺失的类别 ①___________ 和化学式②___________ 。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2 ②Fe ③NaOH ④H2SO4 ⑤AgNO3
从物质类别 上看,FeCl3属于___________ ,可能与___________ 发生反应(填序号);从化合价角度看,Fe3+具有___________ 性,可能与___________ 发生反应(填序号)。
(3)宋代《千里江山图》描绘了山清水秀的美丽景色,来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),
经千年色彩依然,其中绿色来自蓝铜矿(主要成分为Cu(OH)2·2CuCO3)。其中Cu(OH)2·2CuCO3属于___________ (填“纯净物”或“混合物”),请写出Cu(OH)2·2CuCO3与盐酸反应的化学方程式 ___________
(4)酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,H3PO2水溶液中存在H3PO2分子。
①H3PO2属于___________ 酸;NaH2PO2为___________ 盐(填序号)
a. 一元酸 b.二元酸 c.三元酸 d.强酸 e.弱酸 f.正盐 g.酸式盐
②写出H3PO2溶液与足量NaOH溶液反应的化学方程式___________ 。
(1)下图为铁及其化合物的“价-类”二维图。

填写二维图缺失的
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2 ②Fe ③NaOH ④H2SO4 ⑤AgNO3
从物质
(3)宋代《千里江山图》描绘了山清水秀的美丽景色,来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),
经千年色彩依然,其中绿色来自蓝铜矿(主要成分为Cu(OH)2·2CuCO3)。其中Cu(OH)2·2CuCO3属于
(4)酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,H3PO2水溶液中存在H3PO2分子。
①H3PO2属于
a. 一元酸 b.二元酸 c.三元酸 d.强酸 e.弱酸 f.正盐 g.酸式盐
②写出H3PO2溶液与足量NaOH溶液反应的化学方程式
您最近一年使用:0次
3 . 某废旧金属材料中主要为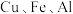 及其氧化物的混合物。利用该废旧金属材料制备胆矾
及其氧化物的混合物。利用该废旧金属材料制备胆矾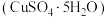 的一种流程如下:
的一种流程如下: 可将
可将 与
与 分离,但不能将
分离,但不能将 与
与 分离。
分离。
回答下列问题:
(1)“破碎”的目的是___________ 。
(2)“碱浸”时发生反应的离子方程式为___________ 。
(3)“酸浸、氧化”的温度不宜过高,原因是___________ ;“滤渣2”的主要成分是___________ (填化学式)。
(4)下列选项中可以检验酸浸、氧化后溶液里是否含有 的是___________。
的是___________。
(5)测定产品的纯度:准确称取胆矾样品 ,完全溶解于稀硫酸中,用过量的
,完全溶解于稀硫酸中,用过量的 溶液沉淀其中的铜元素,得到蓝色沉淀质量为
溶液沉淀其中的铜元素,得到蓝色沉淀质量为 。该样品纯度为
。该样品纯度为___________ (保留3位有效数字)。
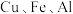 及其氧化物的混合物。利用该废旧金属材料制备胆矾
及其氧化物的混合物。利用该废旧金属材料制备胆矾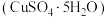 的一种流程如下:
的一种流程如下: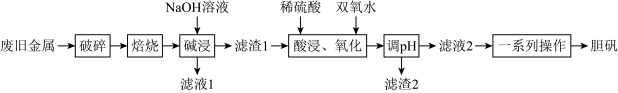
 可将
可将 与
与 分离,但不能将
分离,但不能将 与
与 分离。
分离。回答下列问题:
(1)“破碎”的目的是
(2)“碱浸”时发生反应的离子方程式为
(3)“酸浸、氧化”的温度不宜过高,原因是
(4)下列选项中可以检验酸浸、氧化后溶液里是否含有
 的是___________。
的是___________。A. 溶液,新制氯水 溶液,新制氯水 | B.酸性高锰酸钾溶液 |
C. 溶液 溶液 | D.淀粉 试纸 试纸 |
(5)测定产品的纯度:准确称取胆矾样品
 ,完全溶解于稀硫酸中,用过量的
,完全溶解于稀硫酸中,用过量的 溶液沉淀其中的铜元素,得到蓝色沉淀质量为
溶液沉淀其中的铜元素,得到蓝色沉淀质量为 。该样品纯度为
。该样品纯度为
您最近一年使用:0次
名校
4 . 2022年央视春晚的节目《只此青绿》提到了颜料石绿{铜绿,又名孔雀石,主要成分是碱式碳酸铜[Cu2(OH)2CO3]}。某同学利用下述反应实现了“铜→铜绿→……→铜”的转化。
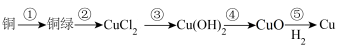
回答下列问题:
(1)铜在潮湿的空气中容易产生铜绿,铜绿的主要成分碱式碳酸铜属于___________ (填“正盐”、“酸式盐”、“碱式盐”),该反应中氧化剂为___________ (填化学式),被氧化的元素为___________ (填元素符号)。
(2)过程②中,将碱式碳酸铜溶于___________ (填名称)中得到CuCl2溶液,写出该反应的离子方程式:___________ 。
(3)过程③中,在CuCl2中滴加X溶液,溶液X呈___________ (填“酸”或“碱”)性,溶液中出现蓝色絮状沉淀,写出生成该蓝色沉淀的离子方程式:___________ 。

回答下列问题:
(1)铜在潮湿的空气中容易产生铜绿,铜绿的主要成分碱式碳酸铜属于
(2)过程②中,将碱式碳酸铜溶于
(3)过程③中,在CuCl2中滴加X溶液,溶液X呈
您最近一年使用:0次
名校
解题方法
5 . 某同学利用实验室中几种等浓度(相同体积的溶液里含相同数目的溶质)溶液:
①NaOH溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液,进行以下实验。
溶液,进行以下实验。
(1)将表格补充完整。a___________ b___________
(2)该同学认为从理论上即可推测①与④不反应,依据是:___________
(3)写出②与④发生反应的离子反应方程式:___________
(4)该同学认为①与②可发生反应但无明显现象,因此选用以上给出的四种溶液设计了简单实验证明了反应确实发生。将该同学的实验方案补充完整:向盛有2mL①的试管中加入1mL②,___________ (从操作、现象、结论方面描述)。
①NaOH溶液 ②
 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液,进行以下实验。
溶液,进行以下实验。| 序号 | 操作 | 现象 | 离子方程式 |
| ⅰ | 向盛有2mL①的试管中加入1mL③ | 产生蓝色沉淀 | a |
| ⅱ | 向盛有2mL②的试管中加入1mL④ | b |
(2)该同学认为从理论上即可推测①与④不反应,依据是:
(3)写出②与④发生反应的离子反应方程式:
(4)该同学认为①与②可发生反应但无明显现象,因此选用以上给出的四种溶液设计了简单实验证明了反应确实发生。将该同学的实验方案补充完整:向盛有2mL①的试管中加入1mL②,
您最近一年使用:0次
6 . 某无色透明溶液中可能大量含有 、
、 、
、 、
、 、
、 、
、 中的若干种,现对其进行如下实验:
中的若干种,现对其进行如下实验:
i:取少量该溶液,加入过量 溶液,产生白色沉淀,过滤;
溶液,产生白色沉淀,过滤;
ii:向i中所得沉淀中加入足量盐酸,沉淀全部溶解,并有无色气体生成;
iii:向i中所得滤液中加入足量硝酸酸化后,再加入 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
回答下列问题:
(1)无需实验即可推断溶液中一定不会大量存在的离子为___________ 。
(2)通过实验i可知溶液中一定不会大量存在的离子为___________ 。
(3)由实验ii可知溶液中一定不会大量存在的离子为___________ 。
(4)由上述实验得到结论:该溶液一定大量存在的离子为___________ ,可能大量存在的离子为___________ 。
(5)写出实验ii中沉淀溶解的离子方程式___________ 。
 、
、 、
、 、
、 、
、 、
、 中的若干种,现对其进行如下实验:
中的若干种,现对其进行如下实验:i:取少量该溶液,加入过量
 溶液,产生白色沉淀,过滤;
溶液,产生白色沉淀,过滤;ii:向i中所得沉淀中加入足量盐酸,沉淀全部溶解,并有无色气体生成;
iii:向i中所得滤液中加入足量硝酸酸化后,再加入
 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。回答下列问题:
(1)无需实验即可推断溶液中一定不会大量存在的离子为
(2)通过实验i可知溶液中一定不会大量存在的离子为
(3)由实验ii可知溶液中一定不会大量存在的离子为
(4)由上述实验得到结论:该溶液一定大量存在的离子为
(5)写出实验ii中沉淀溶解的离子方程式
您最近一年使用:0次
解题方法
7 . 传世名画《千里江山图》的主要取景地是庐山与鄱阳湖,其采用的绿蓝两种颜料——优质孔雀石【Cu2(OH)2CO3】和蓝铜矿【Cu2(OH)2(CO3)2】。
(1)从地表采掘的孔雀石【Cu2(OH)2CO3】,还是古代冶炼铜的原料。流程如下:
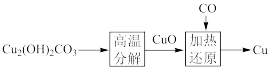
孔雀石【Cu2(OH)2CO3】中铜元素的化合价为___________ ,其高温分解的化学方程式是___________ ;加热还原过程中氧化剂、还原剂分别为___________ 、___________ 。
(2)地表深处的黄铜矿(CuFeS2)被氧气氧化:xCuFeS2+yO2→zCu2++qFe2++nSO ;形成Cu2+流入地表后,遇到石灰石形成孔雀石,同时还有CaSO4和CO2生成。
;形成Cu2+流入地表后,遇到石灰石形成孔雀石,同时还有CaSO4和CO2生成。
①x=___________ ,y=___________ 。
②形成孔雀石的化学方程式是___________ 。
③孔雀石虽然较稳定,遇到足量盐酸则完全溶解,其离子方程式为___________ 。
④Cu2+流入地表后可以形成孔雀石、蓝铜矿或Cu(OH)2三种矿物质,当HCO 浓度相对较大时,产物主要取决于地表水溶液的pH大小。弱酸性水中,一般以
浓度相对较大时,产物主要取决于地表水溶液的pH大小。弱酸性水中,一般以___________ (填化学式)为主;pH>10的碱性水中,一般以___________ (填化学式)为主。
(1)从地表采掘的孔雀石【Cu2(OH)2CO3】,还是古代冶炼铜的原料。流程如下:
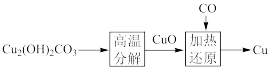
孔雀石【Cu2(OH)2CO3】中铜元素的化合价为
(2)地表深处的黄铜矿(CuFeS2)被氧气氧化:xCuFeS2+yO2→zCu2++qFe2++nSO
 ;形成Cu2+流入地表后,遇到石灰石形成孔雀石,同时还有CaSO4和CO2生成。
;形成Cu2+流入地表后,遇到石灰石形成孔雀石,同时还有CaSO4和CO2生成。①x=
②形成孔雀石的化学方程式是
③孔雀石虽然较稳定,遇到足量盐酸则完全溶解,其离子方程式为
④Cu2+流入地表后可以形成孔雀石、蓝铜矿或Cu(OH)2三种矿物质,当HCO
 浓度相对较大时,产物主要取决于地表水溶液的pH大小。弱酸性水中,一般以
浓度相对较大时,产物主要取决于地表水溶液的pH大小。弱酸性水中,一般以
您最近一年使用:0次
8 . 钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
(1) 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:

①生成 的化学方程式是
的化学方程式是_______ 。
② 样品加水溶解的化学方程式为
样品加水溶解的化学方程式为_______ ,样液中加入 后产生
后产生 ,说明
,说明 与水反应的过程中生成了
与水反应的过程中生成了_______ (填化学式)。
③滤液中加入 溶液产生白色沉淀,说明
溶液产生白色沉淀,说明 样品中含有碳酸钠杂质,生成白色沉淀的离子方程式为
样品中含有碳酸钠杂质,生成白色沉淀的离子方程式为_______ 。
(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠( ,能溶于水)的工艺流程如图:
,能溶于水)的工艺流程如图:
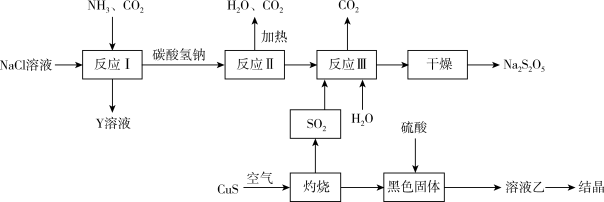
①反应Ⅱ的化学方程式为_______ 。
②关于该流程,下列说法正确的是_______ (填字母)
A.反应Ⅰ属于氧化还原反应 B.该流程中, 可以循环使用
可以循环使用
C.反应Ⅰ中应先通入 ,再通入
,再通入 D.溶液乙通过蒸发浓缩、冷却结晶可得硫酸铜晶体
D.溶液乙通过蒸发浓缩、冷却结晶可得硫酸铜晶体
(3) 在空气中灼烧的化学方程式为
在空气中灼烧的化学方程式为_______ 。
(1)
 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:
①生成
 的化学方程式是
的化学方程式是②
 样品加水溶解的化学方程式为
样品加水溶解的化学方程式为 后产生
后产生 ,说明
,说明 与水反应的过程中生成了
与水反应的过程中生成了③滤液中加入
 溶液产生白色沉淀,说明
溶液产生白色沉淀,说明 样品中含有碳酸钠杂质,生成白色沉淀的离子方程式为
样品中含有碳酸钠杂质,生成白色沉淀的离子方程式为(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠(
 ,能溶于水)的工艺流程如图:
,能溶于水)的工艺流程如图:
①反应Ⅱ的化学方程式为
②关于该流程,下列说法正确的是
A.反应Ⅰ属于氧化还原反应 B.该流程中,
 可以循环使用
可以循环使用C.反应Ⅰ中应先通入
 ,再通入
,再通入 D.溶液乙通过蒸发浓缩、冷却结晶可得硫酸铜晶体
D.溶液乙通过蒸发浓缩、冷却结晶可得硫酸铜晶体(3)
 在空气中灼烧的化学方程式为
在空气中灼烧的化学方程式为
您最近一年使用:0次
2023-11-14更新
|
261次组卷
|
2卷引用:重庆市第十一中学校2023-2024学年高一上学期期中考试化学试题
名校
解题方法
9 . 已知:①铜矿石中含有Cu2(OH)2CO3及含铁元素的杂质;
②黄铵铁矾化学式为(NH4)xFey(SO4)m(OH)n,其中铁为+3价;黄铵铁矾可完全溶于盐酸中;
③Fe(OH)3受热易分解为Fe2O3。
某兴趣小组利用该铜矿石制黄铵铁矾的流程如图_______ mol。
(2)黄铵铁矾化学式中x、y、m、n之间的等量关系式是_______ 。
(3)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取Wg样品,加盐酸完全溶解后,向其中加入足量NaOH溶液并加热,收集到标准状况下560.0mL的气体(假设气体全部逸出)。将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末6.000g。
b.再称取Wg样品,加盐酸完全溶解后,向其中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀11.65g。
①由实验a可计算Wg样品中n(Fe3+)=_______ mol,如何检验实验a中沉淀是否洗涤干净?_______ 。由实验b可计算Wg样品中n( )=
)=_______ mol。
②黄铵铁矾的化学式为_______ 。
②黄铵铁矾化学式为(NH4)xFey(SO4)m(OH)n,其中铁为+3价;黄铵铁矾可完全溶于盐酸中;
③Fe(OH)3受热易分解为Fe2O3。
某兴趣小组利用该铜矿石制黄铵铁矾的流程如图

(2)黄铵铁矾化学式中x、y、m、n之间的等量关系式是
(3)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取Wg样品,加盐酸完全溶解后,向其中加入足量NaOH溶液并加热,收集到标准状况下560.0mL的气体(假设气体全部逸出)。将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末6.000g。
b.再称取Wg样品,加盐酸完全溶解后,向其中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀11.65g。
①由实验a可计算Wg样品中n(Fe3+)=
 )=
)=②黄铵铁矾的化学式为
您最近一年使用:0次
名校
解题方法
10 . 某无色透明溶液中可能大量存在Ag+、Mg2+、Fe3+、Cu2+中的一种或几种。请回答下列问题:
(1)不用做任何实验就可以肯定溶液中不存在的离子是___________
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是___________ ,有关反应的离子方程式为___________
(3)取(2)的滤液加入过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是___________ ,生成沉淀的离子方程式为___________
(4)原溶液中可能大量存在的阴离子是___________ (填序号)。
A.Cl- B. C.OH-
C.OH-
(1)不用做任何实验就可以肯定溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是
(3)取(2)的滤液加入过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是
(4)原溶液中可能大量存在的阴离子是
A.Cl- B.
 C.OH-
C.OH-
您最近一年使用:0次



