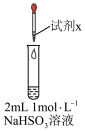
1 . 实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
已知:Cu+ [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
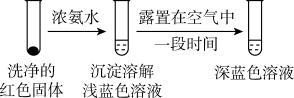
(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为___________ 。
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是___________ 。
②实验表明假设b合理,实验I反应的离子方程式有___________ 、 。
。
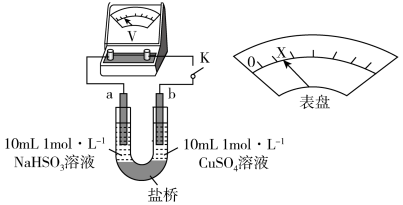
(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-___________ 。
下述实验III证实了假设合理,装置如下图。___________ (补全实验操作及现象)。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和 。
。
①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是___________ 。___________ 。
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:___________ 。
| 实验 | 装置 | 试剂x | 操作及现象 |
| I |
| 1 mol/LCuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅 |
| II | 1 mol/LCuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化 |
 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设a不合理,实验证据是
②实验表明假设b合理,实验I反应的离子方程式有
 。
。(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-
下述实验III证实了假设合理,装置如下图。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和
 。
。①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:
您最近一年使用:0次
名校
2 . 氯化亚铜化学式为CuCl,白色立方结晶或白色粉末,难溶于水,在潮湿的空气中易氧化,不溶于乙醇,常用作催化剂、杀菌剂、媒染剂、脱色剂等。
I.CuCl的制备
取25g CuSO4∙5H2O和6.43gNaCl并加少量水溶解,将溶液倒入如图所示的三颈烧瓶中,加热至50℃,向三颈烧瓶中缓慢滴加Na2SO3和Na2CO3的混合溶液,使其持续反应30min。待反应结束后将混合物静置一段时间,抽滤,沉淀依次用36%的乙酸、无水乙醇、无水乙醚洗涤多次,得白色固体,真空或者充氮气保存。___________ 。
(2)反应时使用NaCl浓溶液,主要目的是___________ 。
(3)三颈烧瓶中CuSO4、NaCl、Na2SO3反应生成CuCl的离子方程式为___________ ;缓慢滴加Na2SO3和Na2CO3的混合溶液的主要原因是___________ 。
(4)沉淀用无水乙醇洗涤的目的是___________ 。
II.CuCl样品纯度的测定
准确称取CuCl样品0.25g,将其置于足量FeCl3溶液中,待固体完全溶解后,加水50mL和邻菲啰啉指示剂2滴,立即用amol∙L-1 Ce(SO4)2标准溶液滴定至绿色出现且30s不褪色,即为终点,重复2~3次,平均消耗Ce(SO4)2标准溶液bmL(已知: ,
, )
)
(5)滴定时应将Ce(SO4)2标准溶液加入___________ (填“酸式滴定管”或“碱式滴定管”)中;该样品中CuCl的质量分数为___________ ×100%。(用含a、b的代数式表示,列出计算式即可)
(6)下列操作可能会导致样品纯度测量结果偏低的是___________。(填标号)
I.CuCl的制备
取25g CuSO4∙5H2O和6.43gNaCl并加少量水溶解,将溶液倒入如图所示的三颈烧瓶中,加热至50℃,向三颈烧瓶中缓慢滴加Na2SO3和Na2CO3的混合溶液,使其持续反应30min。待反应结束后将混合物静置一段时间,抽滤,沉淀依次用36%的乙酸、无水乙醇、无水乙醚洗涤多次,得白色固体,真空或者充氮气保存。

(2)反应时使用NaCl浓溶液,主要目的是
(3)三颈烧瓶中CuSO4、NaCl、Na2SO3反应生成CuCl的离子方程式为
(4)沉淀用无水乙醇洗涤的目的是
II.CuCl样品纯度的测定
准确称取CuCl样品0.25g,将其置于足量FeCl3溶液中,待固体完全溶解后,加水50mL和邻菲啰啉指示剂2滴,立即用amol∙L-1 Ce(SO4)2标准溶液滴定至绿色出现且30s不褪色,即为终点,重复2~3次,平均消耗Ce(SO4)2标准溶液bmL(已知:
 ,
, )
)(5)滴定时应将Ce(SO4)2标准溶液加入
(6)下列操作可能会导致样品纯度测量结果偏低的是___________。(填标号)
| A.样品在空气中放置时间过长 |
| B.盛装Ce(SO4)2标准溶液的滴定管未用标准溶液润洗 |
| C.锥形瓶中装待测液前未干燥 |
| D.滴定管内部滴定前无气泡,滴定后有气泡 |
您最近一年使用:0次
2024-04-02更新
|
574次组卷
|
4卷引用:山西省太原市2024届高三一模理综试卷-高中化学
山西省太原市2024届高三一模理综试卷-高中化学(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
23-24高二上·浙江台州·期中
名校
解题方法
3 . 碱式碳酸铜[ ,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为
,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
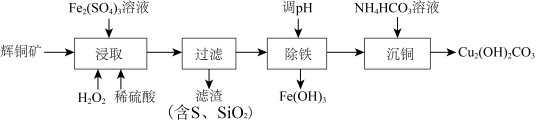
(1)“浸取”时能提高辉铜矿Cu浸取率的措施有___________ (填2条)
(2)某小组测得Cu浸取率随 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:

①由图一可知 适宜的浓度范围为
适宜的浓度范围为___________ ;
②由图一中的a点分析,浸取时 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为___________ 。
③图二中高于85℃时Cu浸取率下降的原因是___________ 。
(3)①“除铁”步骤调pH可加入试剂___________ (填选项字母);
a.HCl b.NaOH c.CuO d.
②常温下,“过滤”后的滤液中 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于___________ 。[常温下,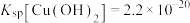 ]。
]。
(4)某实验小组为测定碱式碳酸铜的纯度,取制得的碱式碳酸铜产品5.0g,加适量硫酸,再加100mL水,加热溶解,冷却后配成250mL溶液。量取配成的25.00mL溶液于碘量瓶中,加入适量缓冲溶液控制溶液的pH在3~4之间,以及过量的碘化钾,摇匀,于暗处放置5分钟。用 的
的 溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入
溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入 溶液至滴定终点。平行测定3次,实验数据如下表所示。
溶液至滴定终点。平行测定3次,实验数据如下表所示。
已知: ,
,
①判断滴定到达终点的现象是___________ ;
②根据表中数据计算实验小组制得的碱式碳酸铜的纯度为___________ 。
(5)对下列几种假定情况进行讨论(填“偏高”、“偏低”或“无影响”);
①装 溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是
溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是___________ ;
②读 溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是
溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是___________ 。
 ,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为
,相对分子质量为222]可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
(1)“浸取”时能提高辉铜矿Cu浸取率的措施有
(2)某小组测得Cu浸取率随
 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:
①由图一可知
 适宜的浓度范围为
适宜的浓度范围为②由图一中的a点分析,浸取时
 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为③图二中高于85℃时Cu浸取率下降的原因是
(3)①“除铁”步骤调pH可加入试剂
a.HCl b.NaOH c.CuO d.

②常温下,“过滤”后的滤液中
 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于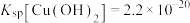 ]。
]。(4)某实验小组为测定碱式碳酸铜的纯度,取制得的碱式碳酸铜产品5.0g,加适量硫酸,再加100mL水,加热溶解,冷却后配成250mL溶液。量取配成的25.00mL溶液于碘量瓶中,加入适量缓冲溶液控制溶液的pH在3~4之间,以及过量的碘化钾,摇匀,于暗处放置5分钟。用
 的
的 溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入
溶液进行滴定,至临近滴定终点时再加入1mL淀粉溶液做指示剂,继续滴入 溶液至滴定终点。平行测定3次,实验数据如下表所示。
溶液至滴定终点。平行测定3次,实验数据如下表所示。已知:
 ,
,
| 实验编号 | 滴定前 溶液的体积读数/mL 溶液的体积读数/mL | 滴定后 溶液的体积读数/mL 溶液的体积读数/mL |
| 1 | 0.10 | 20.12 |
| 2 | 1.20 | 23.21 |
| 3 | 1.50 | 21.48 |
②根据表中数据计算实验小组制得的碱式碳酸铜的纯度为
(5)对下列几种假定情况进行讨论(填“偏高”、“偏低”或“无影响”);
①装
 溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是
溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是②读
 溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是
溶液体积时,若滴定前仰视,滴定后俯视,对测定结果的影响是
您最近一年使用:0次
2022·全国·高考真题
4 . 二草酸合铜(Ⅱ)酸钾( )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸( )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由 配制Ⅰ中的
配制Ⅰ中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是________ (填仪器名称)。

(2)长期存放的 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是________ 。
(3)Ⅰ中的黑色沉淀是________ (写化学式)。
(4)Ⅱ中原料配比为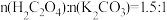 ,写出反应的化学方程式
,写出反应的化学方程式________ 。
(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入 应采取
应采取________ 的方法。
(6)Ⅲ中应采用________ 进行加热。
(7)Ⅳ中“一系列操作”包括________ 。
 )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:Ⅰ.取已知浓度的
 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。Ⅱ.向草酸(
 )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由
 配制Ⅰ中的
配制Ⅰ中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是
(2)长期存放的
 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是(3)Ⅰ中的黑色沉淀是
(4)Ⅱ中原料配比为
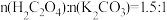 ,写出反应的化学方程式
,写出反应的化学方程式(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入
 应采取
应采取(6)Ⅲ中应采用
(7)Ⅳ中“一系列操作”包括
您最近一年使用:0次
2022-06-09更新
|
19856次组卷
|
25卷引用:题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建
(已下线)题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建2022年高考全国乙卷化学真题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)第10讲 金属材料及金属矿物的开发利用(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题14 化学实验综合题-备战2023年高考化学母题题源解密(全国通用)(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第29讲 化学综合实验(练)-2023年高考化学一轮复习讲练测(全国通用)辽宁省名校联盟2022-2023学年高二上学期10月联考化学试题(已下线)专题27 物质制备类综合性实验题(学生版)-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 大题突破2 综合实验题题型研究(已下线)题型49 物质制备探究型综合实验(已下线)专题03 化学实验专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)湖北省武汉市第六中学2023-2024学年高三上学期第一次月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)黑龙江省哈尔滨市第三十二中学校2023-2024学年高三上学期11月期中考试化学试题吉林省延边第二中学2022-2023学年高三上学期开学调研考试化学试题山东省枣庄市第三中学2022-2023学年高三上学期开学考试化学试题甘肃省武威第十八中学2021-2022学年高二下学期期末考试化学试卷云南省临沧市第一中学2022-2023学年高二上学期期中考试化学试题