名校
解题方法
1 . 工业电解精炼铜的溶液中含有Zn2+、Cu2+等离子,实验室设计分离出Zn2+并制取胆矾的流程如下:
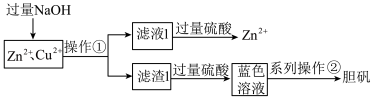
已知:Zn2+与NaOH的反应与Al3+类似。下列说法错误的是

已知:Zn2+与NaOH的反应与Al3+类似。下列说法错误的是
A.滤液1与过量硫酸反应的离子方程式为ZnO +4H+=Zn2++2H2O +4H+=Zn2++2H2O |
| B.操作①和②中用到的玻璃仪器完全相同 |
| C.系列操作②包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥 |
| D.可用无水乙醇洗涤胆矾晶体,除去表面的杂质 |
您最近一年使用:0次
2020-11-01更新
|
507次组卷
|
7卷引用:江苏省连云港市赣榆智贤中学2020-2021学年高二3月月考化学试题
江苏省连云港市赣榆智贤中学2020-2021学年高二3月月考化学试题湖南省永州市2021届高三第一次模拟化学试题(已下线)热点5 常见元素及其化合物的性质与应用-2021年高考化学专练【热点·重点·难点】(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)河南省南阳市第一中学校2021-2022学年高三上学期第二次月考化学试题广东省广州市第一中学2021-2022学年高三下学期2月教学质量监测化学试题(已下线)第一部分 二轮专题突破 专题17 典型实验装置及化学实验基本操作
名校
解题方法
2 . 下列有关物质性质与用途具有对应关系的是( )
| A.Na2S溶液具有碱性,可用于脱除废水中的Hg2+ |
| B.铝具有良好的导热性,可用铝槽车贮运浓硝酸 |
| C.NaHCO3能与碱反应,可用作食品疏松剂 |
| D.CuSO4能使蛋白质变性,可用于游泳池水的消毒 |
您最近一年使用:0次
名校
3 . 氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。写出该反应的离子方程式____________________________ 。
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000 g样品,放入盛有20 mL过量FeCl3 溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50 mL;
c.立即用0.2000 mol/LCe(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积;
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00 mL。已知:CuC1+Fe3+=Cu2++Fe2++Cl-、 Fe2++Ce4+=Fe3++Ce3+
①配制100 mL 0.2000 mol/L的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要______________ 。
②进行步骤c时若操作缓慢,则测得CuCl的纯度________ (填“偏大”、“偏小”或“无影响”)。
③通过计算确定该样品中CuCl的纯度_____________ (写出计算过程)。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。写出该反应的离子方程式
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000 g样品,放入盛有20 mL过量FeCl3 溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50 mL;
c.立即用0.2000 mol/LCe(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积;
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00 mL。已知:CuC1+Fe3+=Cu2++Fe2++Cl-、 Fe2++Ce4+=Fe3++Ce3+
①配制100 mL 0.2000 mol/L的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要
②进行步骤c时若操作缓慢,则测得CuCl的纯度
③通过计算确定该样品中CuCl的纯度
您最近一年使用:0次
4 . 加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。下图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。
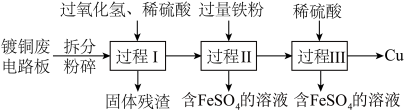
(1)上述流程中,为加快化学反应速率而采取的措施是______ 。
(2)过程Ⅰ中,Cu溶解,过氧化氢的作用是______ 。
(3)过程Ⅱ中,获得Cu的反应的离子方程式为______ 。
(4)过程Ⅲ的目的是______ 。

(1)上述流程中,为加快化学反应速率而采取的措施是
(2)过程Ⅰ中,Cu溶解,过氧化氢的作用是
(3)过程Ⅱ中,获得Cu的反应的离子方程式为
(4)过程Ⅲ的目的是
您最近一年使用:0次
2020-08-04更新
|
300次组卷
|
5卷引用:江苏省宿迁市泗阳县桃州中学2020-2021学年高二上学期第一次调研考试化学试题
名校
5 . 在给定条件下,下列选项所示的物质间转化均能实现的是
A.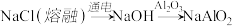 |
B.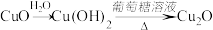 |
C. |
D.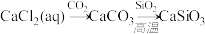 |
您最近一年使用:0次
名校
6 . 实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图所示。
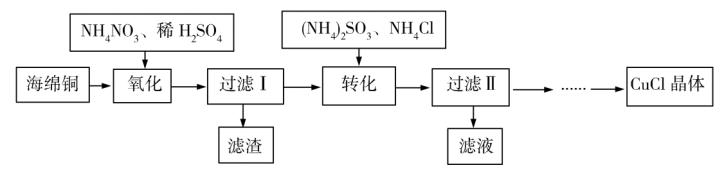
已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60℃~70℃,原因是___ 。
(2)写出“转化”过程中的离子方程式___ 。
(3)“过滤Ⅱ”所得滤液经蒸发浓缩、降温结晶、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是___ 。
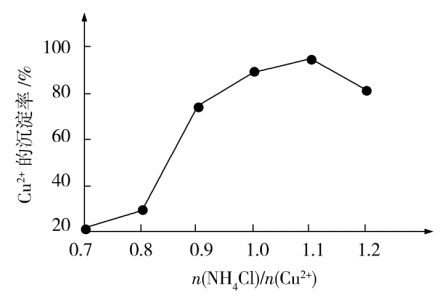
(4)氯化铵用量 与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是___ 。
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:___ 。(实验中可选试剂:0.1mol·L-1盐酸、10mol·L-1盐酸、蒸馏水、无水乙醇)

已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60℃~70℃,原因是
(2)写出“转化”过程中的离子方程式
(3)“过滤Ⅱ”所得滤液经蒸发浓缩、降温结晶、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是
(4)氯化铵用量
 与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:
您最近一年使用:0次
名校
解题方法
7 . 下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将SO2气体通入酸性KMnO4溶液 | 溶液褪色 | SO2具有漂白性 |
| B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀产生,苯层呈紫红色 | Cu2+有氧化性,白色沉淀可能为CuI |
| C | C2H5OH与浓硫酸共热至170℃,产生的气体通入酸性KMnO4溶液 | 溶液紫红色褪去 | C2H5OH与浓硫酸反应生成了乙烯 |
| D | 向5mL0.1mol·L-1KI溶液中加入1mL0.1mol·L-1FeCl3溶液,振荡,用苯萃取2~3次后,取下层溶液滴加5滴KSCN溶液 | 出现血红色 | 反应2Fe3++2I-=2Fe2++I2是有一定限度的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如图:
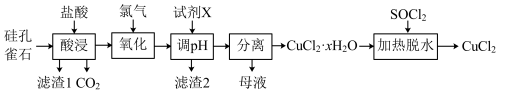
已知:SOCl2+H2O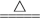 SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3·Cu(OH)2反应的化学方程式为___ 。为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当提高盐酸浓度;②适当提高反应温度;③___ 。
(2)“氧化”时发生反应的离子方程式为___ 。
(3)“滤渣2”的主要成分为___ (填化学式);“调pH”时,pH不能过高,其原因是___ 。

已知:SOCl2+H2O
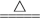 SO2↑+2HCl↑
SO2↑+2HCl↑(1)“酸浸”时盐酸与CuCO3·Cu(OH)2反应的化学方程式为
(2)“氧化”时发生反应的离子方程式为
(3)“滤渣2”的主要成分为
您最近一年使用:0次
名校
解题方法
9 . 印刷线路板废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-),可用来制备碱式碳酸铜,过程如图:
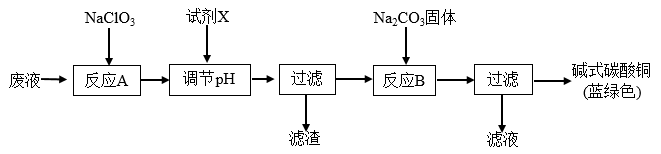
下列说法正确的是( )

下列说法正确的是( )
| A.反应A的离子方程式为:10Fe2++2ClO3-+12H+=10Fe3++Cl2↑+6H2O |
| B.铜在空气中被腐蚀得到铜锈,其主要成分是碱式碳酸铜 |
| C.NaClO3和Na2CO3中心原子杂化类型均为sp3杂化 |
| D.试剂X可为CuO,主要作用是通过调节pH值把Fe2+转化为Fe(OH)3过滤除去 |
您最近一年使用:0次
2020-05-13更新
|
302次组卷
|
4卷引用:江苏省扬州中学2021-2022学年高二下学期6月月考化学试题
江苏省扬州中学2021-2022学年高二下学期6月月考化学试题江苏省连云港市灌南二中、南师大灌云附中2022-2023学年高二下学期第二次阶段性检测化学试题山东省新高考质量测评联盟2020届高三5月联考化学试题(已下线)押广东卷化学第15题 离子方程式正误判断-备战2022年高考化学临考题号押题(广东卷)
名校
解题方法
10 . 以铜片(含少量杂质铁)为原料制取Cu(NO3)2溶液的实验流程如图:
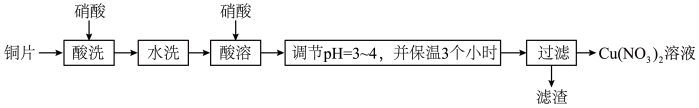
(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:___ 。
(2)“水洗”后检验铜片表面是否洗涤干净的方法是___ 。
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O
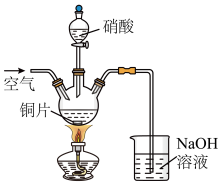
①“酸溶”时为防止反应过于剧烈,可以采取的方法有___ 和___ 。
②通入空气的作用是___ 、___ 。
(4)“调节pH=3~4,并保温3个小时”的目的是___ 。
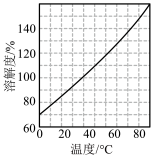
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:___ 。
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:
(2)“水洗”后检验铜片表面是否洗涤干净的方法是
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O

①“酸溶”时为防止反应过于剧烈,可以采取的方法有
②通入空气的作用是
(4)“调节pH=3~4,并保温3个小时”的目的是
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

您最近一年使用:0次
2020-05-09更新
|
139次组卷
|
2卷引用:江苏省如皋中学2020届高三阶段检测化学试题



