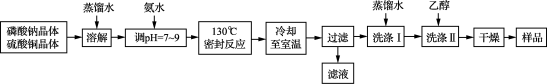
1 . 锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:
主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1) 实验室进行“过滤”操作使用的玻璃仪器主要有____________________ 。
(2) 流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是__________________ 。
(3) 准确称取上述流程所得的样品38.56 g [假定样品中只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量的硝酸中,再加入氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为27.20 g。计算所得样品中磷酸氧铜的质量分数_______ 。(写出计算过程)
主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1) 实验室进行“过滤”操作使用的玻璃仪器主要有
(2) 流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是
(3) 准确称取上述流程所得的样品38.56 g [假定样品中只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量的硝酸中,再加入氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为27.20 g。计算所得样品中磷酸氧铜的质量分数
您最近一年使用:0次
名校
2 . 给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.NaCl(aq)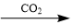 NaHCO3(s) NaHCO3(s)  Na2CO3(s) Na2CO3(s) |
B.CuCl2 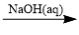 Cu(OH)2 Cu(OH)2  Cu Cu |
C.Al 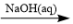 NaAlO2(aq) NaAlO2(aq)  NaAlO2(s) NaAlO2(s) |
D.MgO(s) Mg(NO3)2(aq) Mg(NO3)2(aq)  Mg(s) Mg(s) |
您最近一年使用:0次
2018-12-26更新
|
267次组卷
|
2卷引用:江苏省兴化一中2019届高三上学期12月月考化学试题
名校
3 . 硅酸铜钡是利用最新科学技术才合成的一种物质,然而科学家惊奇发现,我国秦朝兵马俑的一种颜料竟是硅酸铜钡.由以上事实推测关于硅酸铜钡的说法不正确的是
| A.难氧化 | B.难溶于水 | C.属于硅酸盐 | D.属于混合物 |
您最近一年使用:0次
2018-09-10更新
|
164次组卷
|
2卷引用:江苏省盐城市田家炳中学2019届高三上学期开学考试化学试题
4 . 将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的稀硝酸中,固体完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论错误的是
| A.纯净无色气体Y与0.75VmL(标准状况)O2混合后通入水中,气体可被完全吸收 |
| B.若固体与硝酸恰好完全反应,当V=1680时,Cu2O与Cu的物质的量之比为8∶1 |
| C.原混合粉末的总质量可能为9.8 g |
| D.向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,消耗NaOH的物质的量为(0.325-V/22400)mol |
您最近一年使用:0次
13-14高一上·辽宁沈阳·阶段练习
名校
解题方法
5 . 碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于HCl,转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜。溶解28.4 g的上述混合物,消耗1.0 mol/L盐酸500 mL。灼烧等量的上述混合物,得到的氧化铜质量( )
| A.35 g | B.30 g | C.20 g | D.15 g |
您最近一年使用:0次
2020-06-08更新
|
398次组卷
|
17卷引用:江苏省苏州市新实中学2019-2020学年高一上学期第一次(10月)月考试题
江苏省苏州市新实中学2019-2020学年高一上学期第一次(10月)月考试题(已下线)2013-2014学年辽宁省沈阳二中高一上学期12月月考化学试卷2015届辽宁省抚顺市二中高三上学期期中考试化学试卷2014-2015上海市金山中学高一上学期期末考试化学试卷2016届安徽省合肥一六八中学高三上第四次段考化学试卷2016届湖南省长沙市雅礼中学高三上学期月考化学试卷河北省衡水中学2019届高三开学二调考试化学试题安徽省凤阳衡水高考补习学校2019届高三上学期第二次月考化学试题【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高一上学期期末考试化学试题【全国百强校】湖南省长沙市长郡中学2018-2019学年高一下学期开学考试化学试题人教版高一化学必修1第一章—第三章综合测试题(已下线)【南昌新东方】2019 南昌十九中 高一上 期中安徽省阜阳市界首中学2019-2020学年高一下学期期中考试化学试题河北省石家庄市第一中学东校区2022届高三上学期教学质量检测(一)化学试题安徽省当涂第一中学2022-2023学年高一上学期第二次月考化学试题(已下线)专题03 物质的量的基本计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第03讲 物质的量在化学方程式计算中的应用(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
6 . 碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:
(1)试剂1最好选用_________ 。
a.Fe2O3 b.CaCO3 c.CuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,写出该反应的化学方程式________________ 。
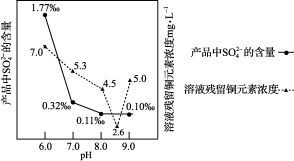
(3)加入Na2CO3沉淀时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在________ 。
(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0克的样品;②高温分解;③测出生成CO2的质量为2.2克;④测出生成水蒸气的质量为1.8克⑤称量生成CuO的质量为8.0g。计算出碱式碳酸铜的组成,写出计算过程。____________________________ 。
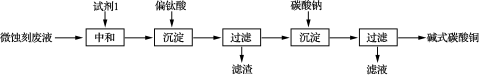
(1)试剂1最好选用
a.Fe2O3 b.CaCO3 c.CuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,写出该反应的化学方程式
(3)加入Na2CO3沉淀时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在
(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0克的样品;②高温分解;③测出生成CO2的质量为2.2克;④测出生成水蒸气的质量为1.8克⑤称量生成CuO的质量为8.0g。计算出碱式碳酸铜的组成,写出计算过程。
您最近一年使用:0次
名校
7 . 下列俗名与物质相匹配的一组是( )
| A.水玻璃——Na2SO4 | B.小苏打——NaHCO3 | C.石膏——CaSiO3 | D.胆矾——FeSO4 |
您最近一年使用:0次
2019-03-09更新
|
329次组卷
|
8卷引用:江苏省江阴一中2018-2019学年高二上学期12月月考化学试题
江苏省江阴一中2018-2019学年高二上学期12月月考化学试题江苏省田家炳中学2018-2019学年高二第二学期学业水平测试第一次模拟考试化学试题广东省仲元中学2016-2017学年高二下学期期中考试(文)化学试题广东省韶关市新丰一中2016-2017学年高一下学期期末学业水平考试化学试题夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——硫及其化合物(强化练习)广东实验中学2020-201学年高一下学期期中考试化学(合格考)试题新疆维吾尔自治区喀什第六中学2022-2023学年高一上学期第一次月考化学试题广东省广州市广东实验中学2020-2021学年高一下学期期中考试(合格考)化学试题
解题方法
8 . 超细铜粉有重要用途,工业上可以通过铝黄铜合金(含Cu、Al、Zn)制超细铜粉。某小组在实验室模拟制备超细铜粉的方法如下:
步骤Ⅰ:取铝黄铜合金加入热浓硫酸溶解,再加入过量NaOH溶液只生成Cu(OH)2沉淀,过滤,洗涤。
步骤Ⅱ:向Cu(OH)2沉淀中加硫酸溶解,再加氨水,形成 [Cu(NH3)4]SO4溶液。
步骤Ⅲ:向[Cu(NH3)4]SO4溶液中通入SO2气体至溶液呈微酸性,生成NH4CuSO3。再与足量的1.000mol·L-1的稀硫酸混合并微热,得到超细铜粉。
(1)步骤Ⅰ中完全溶解铝黄铜合金可以加入稀硫酸和____ 。
A.FeCl3 B.盐酸 C.热空气
(2)配制500 mL 1.000 mol·L-1的稀硫酸,需要用98%的浓硫酸(密度为1.84 g·mL-1)____ mL。
(3)在步骤Ⅲ中生成NH4CuSO3的化学反应方程式为____ 。
(4)准确称取1.000 g铝黄铜合金与足量的1.000 mol·L-1稀硫酸完全反应,生成标准状况下气体体积为134.4 mL。将相同质量的合金完全溶于热的足量的浓硫酸,产生标准状况下气体体积为380.8mL。计算此合金中铜的质量分数________ 。
步骤Ⅰ:取铝黄铜合金加入热浓硫酸溶解,再加入过量NaOH溶液只生成Cu(OH)2沉淀,过滤,洗涤。
步骤Ⅱ:向Cu(OH)2沉淀中加硫酸溶解,再加氨水,形成 [Cu(NH3)4]SO4溶液。
步骤Ⅲ:向[Cu(NH3)4]SO4溶液中通入SO2气体至溶液呈微酸性,生成NH4CuSO3。再与足量的1.000mol·L-1的稀硫酸混合并微热,得到超细铜粉。
(1)步骤Ⅰ中完全溶解铝黄铜合金可以加入稀硫酸和
A.FeCl3 B.盐酸 C.热空气
(2)配制500 mL 1.000 mol·L-1的稀硫酸,需要用98%的浓硫酸(密度为1.84 g·mL-1)
(3)在步骤Ⅲ中生成NH4CuSO3的化学反应方程式为
(4)准确称取1.000 g铝黄铜合金与足量的1.000 mol·L-1稀硫酸完全反应,生成标准状况下气体体积为134.4 mL。将相同质量的合金完全溶于热的足量的浓硫酸,产生标准状况下气体体积为380.8mL。计算此合金中铜的质量分数
您最近一年使用:0次
名校
解题方法
9 . 为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完成如下实验:
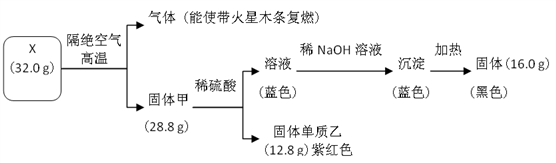
请回答:
(1)X 的化学式是______________ 。
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是______________ 。
(3)写出固体甲与稀硫酸反应的化学方程式______________ 。

请回答:
(1)X 的化学式是
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是
(3)写出固体甲与稀硫酸反应的化学方程式
您最近一年使用:0次
2018-03-14更新
|
471次组卷
|
3卷引用:浙江省舟山中学2017-2018学年高一下学期开学考试化学试题
10 . 在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.MnO2 Cl2 Cl2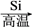 SiCl4 SiCl4 | B.Fe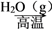 Fe2O3 Fe2O3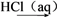 FeCl3 FeCl3 |
C.S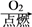 SO2 SO2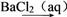 BaSO3 BaSO3 | D.CuSO4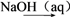 Cu(OH)2 Cu(OH)2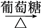 Cu Cu |
您最近一年使用:0次



