解题方法
1 . 氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)下图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
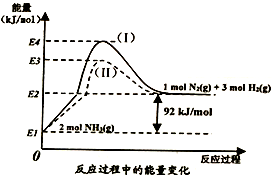
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为__________________________ 。
②过程(I)和过程(Ⅱ)的反应热__________ (填“相同”或“不同”),原因是_______________ 。
③一定温度下,在容积为1L的密闭容器中充入1 mol N2(g)、3molH2(g),达到平衡时,混合气体的总量为2.8 mol,则该条件下反应 N2(g)+3H2(g) 2NH3(g)的平衡常数为
2NH3(g)的平衡常数为__________ ,H2的平衡转化率为__________________________ 。
(2)用NH3可以消除氮氧化物的污染,已知:
反应I:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H1= a kJ/mol
2N2(g)+6H2O(g) △H1= a kJ/mol
反应Ⅱ:N2(g)+O2(g) 2NO(g) △H2= b kJ/mol
2NO(g) △H2= b kJ/mol
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H3= c kJ/mol
5N2(g)+6H2O(g) △H3= c kJ/mol
则:反应Ⅱ中的b=______ kJ/mol(用含a、c的代数式表示),反应Ⅲ中的△S________ 0(填“>”“<”或“=”)。
(3)在恒容的密闭容器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图:
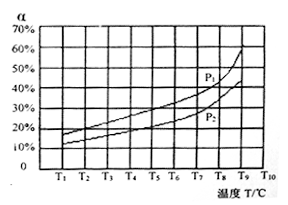
①分析得P1_________ P2 (填“>”“<”或“=”)。
②下列叙述中,不能判断反应Ⅲ已经达到平衡状态的标志是__________ (填序号)。
a. N2的浓度不再改变 b.断裂6molN-H键的同时,有6molH-O键形成
C.容器中压强不再变化 d.混合气体的密度保持不变
(1)下图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:

①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为
②过程(I)和过程(Ⅱ)的反应热
③一定温度下,在容积为1L的密闭容器中充入1 mol N2(g)、3molH2(g),达到平衡时,混合气体的总量为2.8 mol,则该条件下反应 N2(g)+3H2(g)
 2NH3(g)的平衡常数为
2NH3(g)的平衡常数为(2)用NH3可以消除氮氧化物的污染,已知:
反应I:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H1= a kJ/mol
2N2(g)+6H2O(g) △H1= a kJ/mol反应Ⅱ:N2(g)+O2(g)
 2NO(g) △H2= b kJ/mol
2NO(g) △H2= b kJ/mol反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) △H3= c kJ/mol
5N2(g)+6H2O(g) △H3= c kJ/mol则:反应Ⅱ中的b=
(3)在恒容的密闭容器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图:

①分析得P1
②下列叙述中,不能判断反应Ⅲ已经达到平衡状态的标志是
a. N2的浓度不再改变 b.断裂6molN-H键的同时,有6molH-O键形成
C.容器中压强不再变化 d.混合气体的密度保持不变
您最近一年使用:0次
名校
解题方法
2 . 硫的氧化物、氮的氧化物是严重的大气污染物,可以通过以下方法处理:
催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
(l)已知:N2(g)+O2(g) 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol
则反应:2N0(g)+2CO(g) N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=________ kJ/mol。
(2)氮氧化物和碳氧化物在催化剂作用下可发生反应:2C0+2NO(g) N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=
N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=______ 。

(3)用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
①A点的逆反应速率v逆(CO2)_____ B点的正反应速率为v正(CO2)(填“>”、“<”或 “=”)。
(4)SO2可用氢氧化钠来吸收。现有0.4molSO2,若用200mL 3mol·L-1NaOH溶液将其完全吸收,生成物为_____ (填化学式)。经测定所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为________ 。
(5)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:_________ 。
(6)已知常温下Fe(OH)3的Ksp=4.0×10-38。若某氢氧化镁溶液的PH=9,则该溶液中c(Fe3+)最大为_________ 。
催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:
2NO(g)+2CO(g)
 N2(g)+2CO2(g)
N2(g)+2CO2(g)(l)已知:N2(g)+O2(g)
 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol| 化学键 | O=O | C=O | C≡O | N≡N |
| 键能(kJ/mol) |
 N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=(2)氮氧化物和碳氧化物在催化剂作用下可发生反应:2C0+2NO(g)
 N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=
N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=
(3)用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。①A点的逆反应速率v逆(CO2)
(4)SO2可用氢氧化钠来吸收。现有0.4molSO2,若用200mL 3mol·L-1NaOH溶液将其完全吸收,生成物为
(5)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:
(6)已知常温下Fe(OH)3的Ksp=4.0×10-38。若某氢氧化镁溶液的PH=9,则该溶液中c(Fe3+)最大为
您最近一年使用:0次



