解题方法
1 . 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2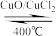 2Cl2+2H2O
2Cl2+2H2O
(1)已知:反应A中,4 mol HCl被氧化,放出116 kJ的热量。

①H2O的结构式是_______ 。
②反应A的热化学方程式是_______ 。
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差为_______ kJ,HCl中H—Cl键比H2O中H—O键(填“强”或“弱”)_______ 。
(2)对于反应A,下图是4种投料比[n(HCl)∶n(O2)],分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是_______ 。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是:投料比越大,对应的温度_______ 。
③投料比为2∶1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______ 。O2转化率为_______ 。
反应A:4HCl+O2
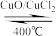 2Cl2+2H2O
2Cl2+2H2O(1)已知:反应A中,4 mol HCl被氧化,放出116 kJ的热量。

①H2O的结构式是
②反应A的热化学方程式是
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差为
(2)对于反应A,下图是4种投料比[n(HCl)∶n(O2)],分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是:投料比越大,对应的温度
③投料比为2∶1、温度为400℃时,平衡混合气中Cl2的物质的量分数是
您最近一年使用:0次
名校
解题方法
2 . 作为绿色氧化剂和消毒剂,H2O2在工业生产及日常生活中应用广泛。已知:2H2O2(l)=2H2O(l)+O2(g) △H = -196kJ·mol-1K = 8.29×1040,回答下列问题:
(1)H2O2的电子式为______ ,H2O2能用作消毒剂是因为分子结构中存在______ 键(选填“H-O”或“-O-O-”)。
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的______ (选填编号)。
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。
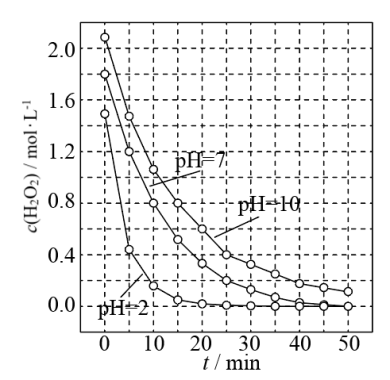
①pH=7时,0~10minH2O2分解反应的平均速率υ=______ mol·L-1·min-1。
②以下对图象的分析正确的是______ (选填序号)。
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因______ 。
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为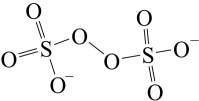 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因_____ 。
(1)H2O2的电子式为
(2)纯H2O2相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是H2O2分解反应的
a.△H比较小 b.反应速率比较小
c. K不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对MnO2催化H2O2分解反应的影响如图所示。

①pH=7时,0~10minH2O2分解反应的平均速率υ=
②以下对图象的分析正确的是
A.相同条件下,H2O2的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,H2O2的分解速率越大
C.在0~50min间,pH=7时H2O2的分解百分率比pH=2时大
(4)液态H2O2是一种极弱的酸,测得常温下电离常数:K1=2.29×10-12,K2=1×10-25,写出H2O2一级电离方程式。H2O2能与碱反应:H2O2+Ba(OH)2==BaO2+2H2O,产物BaO2可以看作H2O2的盐,结合电离常数计算说明(常温)BaO2水溶液有强碱性的原因
(5)H2O2的一种衍生物K2S2O8,其阴离子结构为
 ,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
,K2S2O8水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因
您最近一年使用:0次
2020-12-14更新
|
449次组卷
|
2卷引用:湖北省十一校2021届高三上学期第一次联考化学试题
解题方法
3 . 据文献报道:Fe(CO)5催化某反应的一种反应机理如图所示。下列叙述正确的是( )
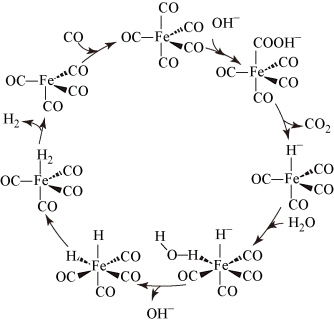

| A.该反应可消耗温室气体CO2 |
| B.OH- 作为中间产物参与了该催化循环 |
| C.该催化循环中Fe的成键数目发生了变化 |
| D.该反应可产生清洁燃料H2 |
您最近一年使用:0次
解题方法
4 . 乙炔、乙烯均是重要的化工原料。回答下列问题:
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)→C2H4ΔH1=—174.3kJ•mol-1 K1(300K)=3.37×1024
C2H2(g)+2H2(g)→C2H6ΔH2=—311.0kJ•mol-1 K2(300K)=1.19×1042
则反应C2H4(g)+H2(g)→C2H6的ΔH=____________ kJ•mol-1,K(300K)=____________ (保留三位有效数字)
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为____________ (填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为____________ kJ•mol-1,该步骤的化学方程式为____________ 。
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g) C2H2(g)+H2(g)。
C2H2(g)+H2(g)。
①乙烯的离解率为α,平衡时容器内气体总压强为p总,则分压p(C2H4)=____________ (用p总和α表示)。
②在1000K时,该反应的Kp=2×10-3atm,平衡时容器内气体的总压强为10atm,则乙烯的离解率为____________ (精确到0.001,已知 ≈1.4)。
≈1.4)。
(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。

该分离膜为____________ (填“阳”或“阴”)离子选择性交换膜;生成乙烯的电极反应式为____________ 。
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)→C2H4ΔH1=—174.3kJ•mol-1 K1(300K)=3.37×1024
C2H2(g)+2H2(g)→C2H6ΔH2=—311.0kJ•mol-1 K2(300K)=1.19×1042
则反应C2H4(g)+H2(g)→C2H6的ΔH=
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g)
 C2H2(g)+H2(g)。
C2H2(g)+H2(g)。①乙烯的离解率为α,平衡时容器内气体总压强为p总,则分压p(C2H4)=
②在1000K时,该反应的Kp=2×10-3atm,平衡时容器内气体的总压强为10atm,则乙烯的离解率为
 ≈1.4)。
≈1.4)。(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。

该分离膜为
您最近一年使用:0次
5 . 碳及其化合物在工农业生产和日常生活中有广泛的应用,对其研究具有重要意义。
回答下列问题:
(1)利用活性炭的___ 作用可去除水中的悬浮杂质。
(2)炭黑可以活化氧分子得到活化氧(O*),活化氧可以快速将SO2氧化为SO3,其活化过程中的能量变化如图所示:
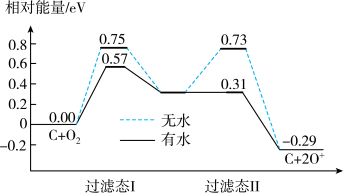
活化过程中有水时的活化能降低了___ eV。在酸雨的形成过程中,炭黑起:___ 作用。
(3)已知:CO(g)+2H2(g) CH3OH(g) ∆H,经测定不同温度下该反应的浓度平衡常数如下:
CH3OH(g) ∆H,经测定不同温度下该反应的浓度平衡常数如下:
①该反应的△H___ 0(填“>”或“<");250℃时,某时刻测得反应体系中c(CO)=0.4mol·L-1、c(H2)=0.4mol·L-1、c(CH3OH)=0.8mol·L-1,则此时v正__ v逆(填“>”、“=”或“<”)。.
②某温度下,在2L刚性容器中,充入0.8molCO和1.6molH2,压强为p,tmin后达到平衡,测得压强为 P。则v(H2)=
P。则v(H2)=____ mol·L-1·min-1,平衡时的Kp=____ 。
(4)科研人员设计了甲烷燃料电池电解饱和食盐水装置如图所示,电池的电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。
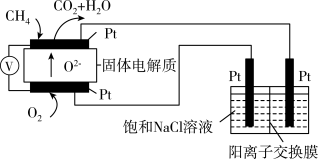
①该电池工作时负极反应方程式为____ 。
②用该电池电解100mL饱和食盐水,若在两极产生的气体体积分别为V1L、V2L(标准状况),且V1>V2,则电解所得溶液的c(OH-)=____ mol·L-1(忽略气体溶解和溶液体积变化)。
回答下列问题:
(1)利用活性炭的
(2)炭黑可以活化氧分子得到活化氧(O*),活化氧可以快速将SO2氧化为SO3,其活化过程中的能量变化如图所示:

活化过程中有水时的活化能降低了
(3)已知:CO(g)+2H2(g)
 CH3OH(g) ∆H,经测定不同温度下该反应的浓度平衡常数如下:
CH3OH(g) ∆H,经测定不同温度下该反应的浓度平衡常数如下:| 温度/℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在2L刚性容器中,充入0.8molCO和1.6molH2,压强为p,tmin后达到平衡,测得压强为
 P。则v(H2)=
P。则v(H2)=(4)科研人员设计了甲烷燃料电池电解饱和食盐水装置如图所示,电池的电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。

①该电池工作时负极反应方程式为
②用该电池电解100mL饱和食盐水,若在两极产生的气体体积分别为V1L、V2L(标准状况),且V1>V2,则电解所得溶液的c(OH-)=
您最近一年使用:0次
2020-06-14更新
|
453次组卷
|
3卷引用:湖北省武汉市2020届高三毕业生六月供题(一)理综化学试题
6 . 铅及其化合物在工业生产、生活中具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=____________ kJ·mol-1(用含a、b、c的代数式表示)
(2)以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为_________ mol。
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq) NaHPbO2(aq),其溶解度曲线如图1所示:
NaHPbO2(aq),其溶解度曲线如图1所示:

结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量________ (填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_______________ (填 “趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(3)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图2所示:

①阴极的电极反应式为______________________ ;
②当有4.14gPb生成时,通过质子交换膜的n(H+)=______________________ 。
(4)PbI2可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00 mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生反应:2RH++PbI2 =R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图3)。加入酚酞指示剂,用0.0050mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液10.00mL。可计算出t℃时Ksp(PbI2)为_________________ 。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=
(2)以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq)
 NaHPbO2(aq),其溶解度曲线如图1所示:
NaHPbO2(aq),其溶解度曲线如图1所示:
结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量
(3)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图2所示:

①阴极的电极反应式为
②当有4.14gPb生成时,通过质子交换膜的n(H+)=
(4)PbI2可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00 mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生反应:2RH++PbI2 =R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图3)。加入酚酞指示剂,用0.0050mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液10.00mL。可计算出t℃时Ksp(PbI2)为
您最近一年使用:0次
2018-07-02更新
|
184次组卷
|
2卷引用:【全国市级联考】湖北省天门市、仙桃市、潜江市2017-2018学年高二下学期期末联考化学试题
解题方法
7 . 以化工厂铬渣(含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠的工艺流程如图所示:
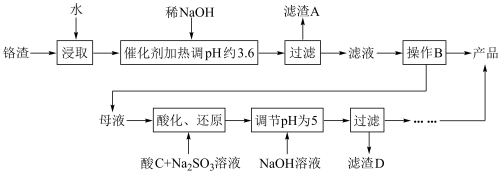
已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
回答下列问题:
(1)根据如图信息,操作B的最佳方法是_________________________________________ 。
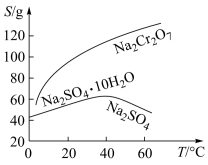
(2)“母液”中主要含有的离子为______________________ 。
(3)酸化后的Cr2O72-可被SO32-还原,该反应的离子方程式为______________________ 。
(4)酸化、还原操作时,酸C和Na2SO3溶液是___________ (填“先后加入”或“混合后加入”),理由是_______________________________________________________ 。
(5)若pH=4.0时,溶液中Cr3+尚未开始沉淀,则溶液中允许Cr3+浓度的最大值为___________ 。
(6)根据2CrO42-+2H+ Cr2O72-+H2O设计如图所示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极与电源的
Cr2O72-+H2O设计如图所示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极与电源的___________ 极相连,其电极反应式为_________________________________ 。透过交换膜的离子为___________ ,该离子移动的方向为___________ (填“a→b”或“b→a”)。


已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
回答下列问题:
(1)根据如图信息,操作B的最佳方法是

(2)“母液”中主要含有的离子为
(3)酸化后的Cr2O72-可被SO32-还原,该反应的离子方程式为
(4)酸化、还原操作时,酸C和Na2SO3溶液是
(5)若pH=4.0时,溶液中Cr3+尚未开始沉淀,则溶液中允许Cr3+浓度的最大值为
(6)根据2CrO42-+2H+
 Cr2O72-+H2O设计如图所示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极与电源的
Cr2O72-+H2O设计如图所示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极与电源的
您最近一年使用:0次
2018-05-16更新
|
384次组卷
|
2卷引用:【全国市级联考】湖北省武汉市2018届高中毕业生五月训练题理科综合化学试题
解题方法
8 . (1)将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位。炼铁高炉中发生的关键反应如下:
C(s)+O2(g)═ CO2(g) △H═-393.5 kJ/mol
CO2(g)+C(s)═ 2CO(g) △H═+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:4Fe(s)+3O2(g)═ 2Fe2O3(s) △H═-648.42 kJ/mol
根据上面三个热化学方程式,回答下列问题:
①高炉内Fe2O3被CO还原为Fe的热化学方程式为________________________ 。
②炼制含铁96%的生铁时,实际生产中所需焦炭远高于理论用量,其原因是_________ 。
(2)在10 L容器中,加入2 mol的SO2(g)和2 mol的NO2(g),保持温度恒定发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。若该温度下向该容器中再继续加入1mol的SO2(g),则:
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。若该温度下向该容器中再继续加入1mol的SO2(g),则:
①化学平衡将_______ (填“向正反应方向”或“向逆反应方向”或“不”)移动;
②当达到新的平衡状态时,容器中SO2(g)的浓度是_______ mol/L;
③最后,SO2的转化率由50%变为_______ %,NO2的转化率变为______ %。
C(s)+O2(g)═ CO2(g) △H═-393.5 kJ/mol
CO2(g)+C(s)═ 2CO(g) △H═+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:4Fe(s)+3O2(g)═ 2Fe2O3(s) △H═-648.42 kJ/mol
根据上面三个热化学方程式,回答下列问题:
①高炉内Fe2O3被CO还原为Fe的热化学方程式为
②炼制含铁96%的生铁时,实际生产中所需焦炭远高于理论用量,其原因是
(2)在10 L容器中,加入2 mol的SO2(g)和2 mol的NO2(g),保持温度恒定发生反应:SO2(g)+NO2(g)
 SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。若该温度下向该容器中再继续加入1mol的SO2(g),则:
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。若该温度下向该容器中再继续加入1mol的SO2(g),则:①化学平衡将
②当达到新的平衡状态时,容器中SO2(g)的浓度是
③最后,SO2的转化率由50%变为
您最近一年使用:0次



